Kardiomiopatia przerostowa kotów w studium subklinicznym
Data publikacji 13/10/2022
Dostępne także w Français , Deutsch , Italiano , Română , Español i English
Kardiomiopatia przerostowa (HCM, hypertrophic cardiomyopathy) jest powszechną chorobą mięśnia sercowego u kotów, jednak jej rozpoznanie bywa trudne. Niniejszy artykuł przedstawia wyczerpujący opis tej choroby i adresowany jest do lekarzy weterynarii pierwszego kontaktu.

Zagadnienia kluczowe
HCM to najpowszechniejsza forma kardiomiopatii u kotów, charakteryzującą się pogrubieniem ścian lewej komory serca i upośledzoną funkcją rozkurczową.
Wykrycie szmerów, arytmii lub rytmu cwałowego u kota bezobjawowego zawsze uzasadnia dalszą diagnostykę kardiologiczną.
W diagnostyce HCM złotym standardem jest echokardiografia, w przebiegu której ważnym wskaźnikiem prognostycznym jest ocena wielkości lewego przedsionka./p>
HCM charakteryzuje się zmiennym przebiegiem i często długą fazą subkliniczną; ocena stopnia zaawansowania klinicznego choroby pomaga określić rokowania i dobrać właściwe metody leczenia lub postępowania.
Wstęp
HCM jest pierwotną postacią kardiomiopatii, w następstwie której dochodzi do pogrubienia ścian lewej komory serca. 1
W przebiegu choroby pojawiają się zaburzenia czynności rozkurczowej (upośledzona relaksacja), zwykle z zachowaną funkcją skurczową (kurczliwością). Zmniejszona elastyczność mięśnia sercowego wpływa na zdolność serca do relaksacji i napełniania się podczas rozkurczu, co w konsekwencji prowadzi do wzrostu ciśnienia rozkurczowego i skutkuje postępującym powiększaniem lewego przedsionka 2
Zmniejszona elastyczność mięśnia sercowego wpływa na zdolność serca do relaksacji i napełniania się podczas rozkurczu, co w konsekwencji prowadzi do wzrostu ciśnienia rozkurczowego i skutkuje postępującym powiększeniem lewego przedsionka.
Catheryn Partington
Etiologia
Rodzinne podłoże HCM u kotów rasy maine coon, ragdoll i sfinks 5
,6
,7
jest wynikiem mutacji białek sarkomeru, ale u wszystkich innych kotów przyczyna choroby pozostaje nieznana, chociaż u kotów rasowych wskazuje się na udział czynników genetycznych. Sarkomer jest podstawową jednostką kurczliwą kardiomiocytów, a mutacje w białkach tworzących jego strukturę skutkują zmianami w budowie i funkcjach sarkomeru, co ostatecznie prowadzi do upośledzenia wydajności kardiomiocytów. Dokładny proces, w którym zmiany sarkomerów prowadzą do wystąpienia fenotypu HCM jest skomplikowany i nie w pełni poznany. Zmiany wrażliwości na wapń, czynności mechanicznej i stresu komórkowego skutkują hipertrofią miocytów, syntezą kolagenu i zaburzeniem układu miocytów – cechami histopatologicznymi kociej HCM 4
,8
.
Dwie różne mutacje białka C wiążącego miozynę w sarkomerze zidentyfikowano u kotów rasy maine coon i ragdoll (odpowiednio A31P i R820W) 5
,6
.
U osobników heterozygotycznych pod względem mutacji choroba przebiega często w postaci subklinicznej, ze zmianami występującymi tylko na poziomie komórkowym, nie uogólnionym. Cięższa postać choroby stwierdzana jest u kotów homozygotycznych; podejrzewa się tu dziedziczną chorobę z niepełną dominacją. U kotów rasy maine coon nie obarczonych mutacją może również wystąpić fenotyp HCM, co wskazuje na prawdopodobną wieloczynnikową etiologię choroby. Niedawno zidentyfikowano mutację w obrębie genu ALMS1* jako czynnik sprawczy HCM u kotów rasy sfinks. 7.
* ALMS1 = zespół Alstroma 1
Patofizjologia
Jak wspomniano powyżej, HCM objawia się przerostem lewej komory i dysfunkcją rozkurczową, co prowadzi do upośledzenia zdolności serca do relaksacji i napełniania się podczas rozkurczu. Ponadto postępujący przerost ściany zmniejsza dopływ krwi do kardiomiocytów, które w miarę obumierania zastępowane są przez tkankę włóknistą, co jeszcze bardziej zmniejsza podatność miokardium (tj. zwiększa się jego sztywność). W konsekwencji ciśnienie rozkurczowe w lewej komorze bez względu na objętość krwi wzrasta, co z kolei zwiększa ciśnienie w lewym przedsionku i skutkuje jego powiększeniem. Podwyższone ciśnienie przedsionka lewego przenoszone jest z powrotem do żył płucnych, a gdy płucne ciśnienie żylne przekroczy 25 mmHg, pojawia się obrzęk płuc- charakterystyczna cecha lewostronnej zastoinowej niewydolności serca 4
. U kotów żyły odprowadzające krew z opłucnej uchodzą do żył płucnych, co przyczynia się do powstania wysięku opłucnowego w przebiegu lewostronnej CHF (w odróżnieniu od psów, u których wysięk opłucnowy jest zawsze wynikiem prawostronnej CHF, nigdy lewej) 4
.
U kotów żyły odprowadzające krew z opłucnej uchodzą do żył płucnych, co przyczynia się do powstania wysięku opłucnowego w przebiegu lewostronnej CHF (w odróżnieniu od psów, u których wysięk opłucnowy jest zawsze wynikiem prawostronnej CHF, nigdy lewej).
Przerost lewej komory u kotów z HCM może dotyczyć zarówno przegrody międzykomorowej, jak i ściany wolnej. Zmiany mogą być też asymetryczne i dotyczyć tylko pewnego obszaru – zazwyczaj podstawnego segmentu przegrody międzykomorowej. Procesem chorobowym objęta bywa również komora prawa, ale wzorzec i rozmieszczenie zmian są bardzo różne u poszczególnych osobników 4
. W przebiegu HCM może dojść także do zmian w aparacie zastawkowym, w tym do wydłużenia przedniego płatka zastawki mitralnej i przerostu mięśni brodawkowatych. Skurczowy ruch do przodu (SAM, systolic anterior motion) przedniego płatka zastawki mitralnej w kierunku przegrody międzykomorowej jest typowy dla HCM i może skutkować ciężkim zawężeniem drogi odpływu lewej komory (LVOTO, left ventricular outflow tract obstruction) 9
,10
.


Ryc. 1. Rozmieszczenie przerostu lewej komory w HCM kotów może być bardzo różne u poszczególnych osobników, ale w obu przedstawionych wyżej przypadkach widoczny jest uogólniony przerost lewej komory
Skróty: LVFW – wolna ściana lewej komory serca; IVS – przegroda międzykomorowa; RV – prawa komora serca
Dzięki uprzejmości Emanuele Ricci, University of Liverpool, Wielka Brytania.

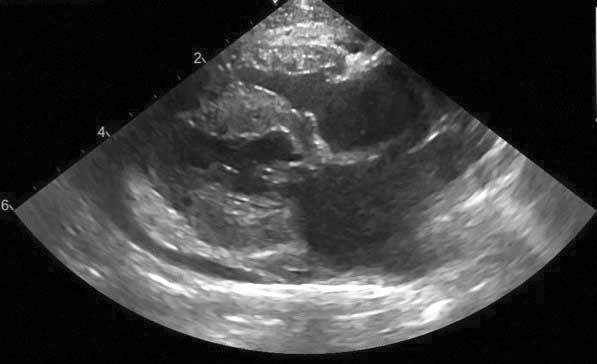
Ryc. 2a. Obrazy echokardiograficzne HCM mogą wykazywać dużą zmienność. Projekcja prawostronna przymostkowa w osi długiej pięciojamowa. Widoczny ogniskowy obszar przerostu w obrębie segmentu podstawnego przegrody międzykomorowej (*).
Źródło: Catheryn Partington – Joanna Dukes-McEwan

Ryc. 2b. Obrazy echokardiograficzne HCM mogą wykazywać dużą zmienność. Projekcja prawostronna przymostkowa w osi krótkiej na poziomie mięśni brodawkowatych przedstawiająca przerost lewej komory i mięśni brodawkowatych.
Źródło: Catheryn Partington – Joanna Dukes-McEwan

Ryc. 2c. Obrazy echokardiograficzne HCM mogą wykazywać dużą zmienność. Projekcja prawostronna przymostkowa w osi długiej czterojamowa. Widoczny symetryczny przerost przegrody międzykomorowej i wolnej ściany lewej komory serca.
Źródło: Catheryn Partington – Joanna Dukes-McEwan
Skróty: LA – lewy przedsionek; LV – lewa komora; Pm – mięsień brodawkowaty
Zawężanie drogi odpływu lewej komory (LVOTO)
U niektórych kotów z HCM występuje znaczny stopień LVOTO (Figure 3). Takie przypadki klasycznie określane były jako kardiomiopatia przerostowa zawężająca (HOCM, hypertrophic obstructive cardiomyopathy), termin ten przestał być jednak stosowany w medycynie ludzkiej, ponieważ LVOTO może mieć charakter przerywany; to samo dotyczy kotów, dlatego termin ten jest prawdopodobnie przestarzały 3
,9
,11
Do zawężenia drogi odpływu może dochodzić w wyniku SAM, ogniskowego przerostu części podstawnej przegrody międzykomorowej lub, rzadziej, śródkomorowego zawężenia lewej komory na skutek przerostu mięśni brodawkowatych 4
,9
,12
.LVOTO powoduje szmery sercowe wynikające z turbulentnego przepływu krwi. W przypadku SAM zawężenie jest zazwyczaj dynamiczne i nasila się wraz ze zwiększoną kurczliwością serca, jak ma to miejsce podczas fizycznego lub emocjonalnego stresu. Są to sytuacje, które u kotów tłumaczą zmienność występowania i intensywności szmerów sercowych w HCM.
SAM ma miejsce wówczas, gdy przedni płatek zastawki mitralnej (często wydłużony) jest ciągnięty w kierunku drogi odpływu w wyniku przerostu i przemieszczenia mięśnia brodawkowatego, co prowadzi do zwiotczenia strun ścięgnistych 10
Ponieważ droga odpływu ulega zawężeniu w wyniku nieprawidłowego ruchu płatka (lub pogrubienia podstawnego segmentu przegrody międzykomorowej), zwiększa się prędkość krwi i spada ciśnienie, zasysając końcówkę płatka do drogi odpływu i pogłębiając zawężenie (efekt Venturiego) 4
,9
.Uważa się, że SAM zwiększa zapotrzebowanie mięśnia sercowego na tlen i zmniejsza perfuzję wieńcową, podnosząc ryzyko niedokrwienia mięśnia sercowego; jest to prawdopodobnie związane z postępującym przerostem i dysfunkcją mikrokrążenia. Uważa się, że niektóre koty z ciężkim LVOTO wykazują oznaki zmniejszonej wydolności fizycznej i bólu, które przypominają opisywaną u ludzi dusznicę bolesną.

Uważa się, że SAM zwiększa zapotrzebowanie mięśnia sercowego na tlen i zmniejsza perfuzję wieńcową, podnosząc ryzyko niedokrwienia mięśnia sercowego; jest to prawdopodobnie związane z postępującym przerostem i dysfunkcją mikrokrążenia. Uważa się, że niektóre koty z ciężkim LVOTO wykazują oznaki zmniejszonej wydolności fizycznej i bólu, które przypominają opisywaną u ludzi dusznicę bolesną.
Źródło: Catheryn Partington – Joanna Dukes-McEwan

Ryc. 3b. Szmery sercowe u kotów z HCM najczęściej wynikają ze zwężenia drogi odpływu lewej komory (LVOTO). Projekcja prawostronna przymostkowa w osi długiej pięciojamowa. Widoczny ogniskowy obszar przerostu części podstawnej przegrody międzykomorowej (*) jako przyczynę LVOTO..
Źródło: Catheryn Partington – Joanna Dukes-McEwan

Ryc. 3c. Szmery sercowe u kotów z HCM najczęściej wynikają ze zwężenia drogi odpływu lewej komory (LVOTO). Zapis spektralny LVOT przedstawiający zwiększone prędkości przepływów (*) i dwufazowe przyspieszenie przepływu (klasyczne widmo kształtu „sztyletu”), wskazujące na LVOTO.
Dzięki uprzejmości J. Novo Matos, University of Cambridge, Wielka Brytania.
Skróty: Ao – aorta; LA – lewy przedsionek; LV – lewa komora
Przejściowe pogrubienie mięśnia sercowego
Przejściowe pogrubienie mięśnia to ważne rozpoznanie różnicowe fenotypowej HCM. Jest to rzadka i słabo poznana zmiana, ale charakteryzuje się pogrubieniem ścian lewej komory serca i rozszerzeniem lewego przedsionka, które są mniej wyraźne niż w pierwotnej postaci HCM, a objawy kliniczne i zmiany echokardiograficzne całkowicie ustępują w ciągu kilku miesięcy. W przypadku przejściowego pogrubienia mięśnia sercowego rokowania są zatem bardzo dobre. Koty z CHF występującą wtórnie do przejściowego pogrubienia mięśnia sercowego są na ogół młodsze niż koty z pierwotną HCM i często zgłaszane jest zdarzenie poprzedzające (takie jak znieczulenie ogólne). Uważa się, że zwiększona grubość ściany jest spowodowana obrzękiem mięśnia sercowego, z podobieństwami zarówno do ostrego zapalenia mięśnia sercowego, jak i kardiomiopatii wywołanej stresem u ludzi 13
.
Ocena stopnia zaawansowania klinicznego HCM i rokowania
Najnowsze wytyczne American College of Veterinary Medicine (ACVIM) dotyczące klasyfikacji, diagnostyki i leczenia HCM u kotów 14
przedstawiają system oceny stopnia zaawansowania choroby, podobny do tego, który stosowany jest w przypadku przewlekłej zwyrodnieniowej choroby zastawki mitralnej u psów (Ramka 1). System ten może pomóc w ustaleniu czy wskazane jest leczenie, a także zapewnić opiekunom pewien wgląd w to, co ich czeka – ponieważ progresja HCM, a tym samym rokowania, są bardzo zmienne. U niektórych kotów choroba ma charakter postępujący i prowadzi do rozwoju CHF, TE lub nagłej śmierci sercowej, natomiast część osobników pozostaje w stadium subklinicznym i umiera z przyczyn pozasercowych14
,15
. Powód takiej niejednorodności pozostaje niejasny i trudno jest przewidzieć, u których kotów dojdzie do rozwoju objawów, chociaż w kilku badaniach retrospektywnych zidentyfikowano szereg czynników prognostycznych. Okresy przeżycia u kotów zdiagnozowanych w młodszym wieku są zwykle dłuższe 2
. Koty, u których doszło do rozwoju objawów CHF np. w wyniku stresu lub płynoterapii dożylnej mają zwykle dłuższe okresy przeżycia niż inne koty z HCM w stadium C. Rytm cwałowy serca, arytmia, znaczne poszerzenie lewego przedsionka, upośledzona funkcja skurczowa lewego przedsionka, spontaniczny echokontrast, znaczny przerost ścian (> 9 mm), dysfunkcja skurczowa lewej komory i ogniskowe ścieńczenie ścian wiążą się ze zwiększonym ryzykiem wystąpienia CHF i/lub TE 2
,15
.
Ramka 1. Ocena stopnia zaawansowania HCM wg wytycznych ACVIM.
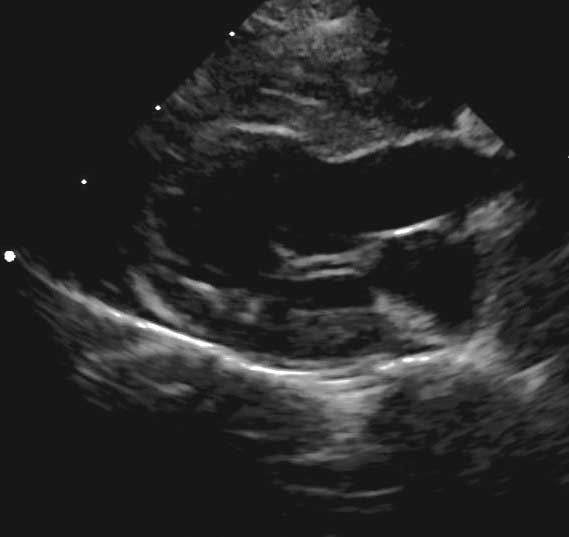 |
Stadium A |
Stadium A: koty predysponowane do wystąpienia kardiomiopatii przerostowej bez żadnych objawów ze strony układu sercowo-naczyniowego; np. maine coon z mutacją w obrębie genu A31P lub kot spokrewniony z osobnikiem, u którego rozpoznano HCM. Struktura serca w badaniu USG prawidłowa. |
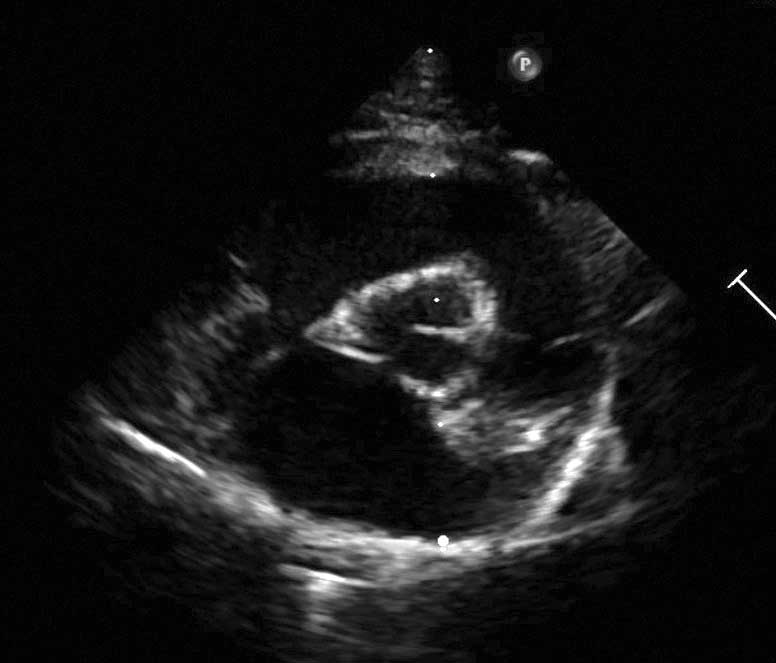 |
Stadium B1 |
Stadium B: koty w stadium subklinicznym (tj. brak objawów klinicznych, ale kardiomiopatia przerostowa ujawniona w badaniu echokardiograficznym). Stadium to podzielone zostało na dwa podtypy, ze względu na stopień zaawansowania oraz ryzyko wystąpienia zastoinowej niewydolności serca i choroby zatorowo-zakrzepowej.
• Stadium B1: niskie ryzyko wystąpienia CHF lub TE, prawidłowy lub nieznacznie powiększony lewy przedsionek.
• Stadium B2: podwyższone ryzyko wystąpienia CHF lub TE, umiarkowanie lub znacznie powiększony lewy przedsionek.
|
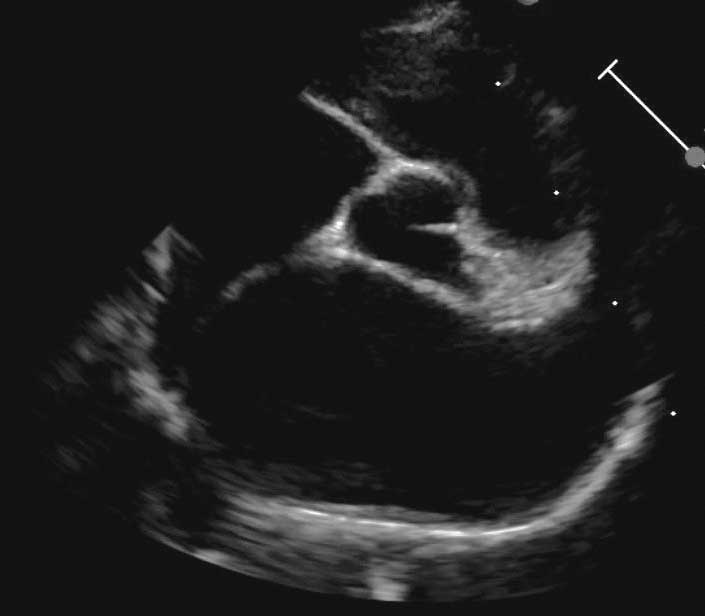 |
Stadium B2 B2 | |
 |
Stadium C | Stadium C: koty z klinicznymi objawami HCM z CHF lub TE. |
 |
Stadium D |
Stadium D: pacjenci z nawracającymi objawami CHF pomimo wdrożonego (standardowego) leczenia.
|
Źródło: Catheryn Partington
Źródło: Catheryn Partington
Ze względu na dysfunkcję rozkurczową i wtórny do tego wzrost ciśnienia dla każdej objętości krwi w lewej komorze, koty z HCM są bardziej wrażliwe na zwiększenie objętości krwi krążącej (tj. wzrost obciążenia wstępnego). Niektóre rodzaje terapii, w tym długotrwałe stosowanie kortykosteroidów i płynoterapii dożylnej, u kota z zaawansowaną postacią HCM mogą przyczynić się do wystąpienia lewostronnej zastoinowej niewydolności serca. Identyfikowanie kotów w subklinicznym stadium choroby jest zatem ważne, aby można odpowiednio zmodyfikować terapię i sposób monitorowania pacjenta (np. wolniejsze tempo podawania wlewów dożylnych, dokładniejsze monitorowanie częstości oddechów i ocena wielkości lewego przedsionka w kolejnych kontrolnych badaniach obrazowych) w celu zmniejszenia ryzyka dekompensacji. Ponadto koty z zaawansowaną postacią HCM są narażone na ryzyko wystąpienia choroby zakrzepowo-zatorowej, a identyfikacja tych osobników pozwala na wdrożenie profilaktycznej terapii przeciwpłytkowej.
Identyfikacja kotów w stadium B może ułatwić wykrycie subtelnych oznak wczesnej progresji do stadium C. Większa świadomość i czujność opiekunów w zakresie objawów zastoinowej niewydolności serca może umożliwić wdrożenie leczenia, zanim wystąpi rozległy obrzęk płuc i ciężkie upośledzenie oddychania.
Jak rozpoznać HCM u kota bezobjawowego?
TWyzwaniem związanym z HCM jest zmienna długość stadium subklinicznym oraz częsty brak jakichkolwiek objawów klinicznych lub zmian w badaniu fizykalnym. Zmiany w badaniu klinicznym, które mogłyby wzbudzić podejrzenie HCM w stadium B, obejmują obecność szmeru (ramka 2), rytmu cwałowego (ramka 3) lub arytmii 4
. Chociaż szmery stwierdzane są w badaniu osłuchowym u wielu bezobjawowych kotów z HCM, aż u 31-62% z nich szmery nie występują; ponadto u 25-33% kotów ze szmerem skurczowym przymostkowym po stronie lewej (zwykle cichym, o niskim nasileniu) brak jest echokardiograficznych dowodów kardiomiopatii 1
,4
. Głośniejsze szmery (powyżej stopnia 3/6) są częściej związane z poważną chorobą serca 4
, ale każdy wykryty szmer wymaga dalszej diagnostyki.
Ramka 2. Przyczyny szmerów w subklinicznym stadium HCM.
|
Szmery sercowe słyszalne są wówczas, gdy przepływ krwi staje się turbulentny; może to być spowodowane dużą prędkością przepływu krwi, dużą średnicą naczyń, dużą gęstością płynu lub niską lepkością. W przebiegu HCM szmery są najczęściej wynikiem zawężenia drogi odpływu lewej komory w wyniku skurczowego ruchu zastawki mitralnej do przodu i/lub ogniskowego przerostu części podstawnej przegrody międzykomorowej.
Ogniskowy przerost podstawnego segmentu przegrody międzykomorowej; przerost lewej komory może dotyczyć tylko obszaru ogniskowego – zazwyczaj podstawnego segmentu przegrody międzykomorowej. Widoczne jest to jako wpuklanie się przerośniętego segmentu lewej komory do LVOT w trakcie skurczu, co prowadzi do zawężania drogi odpływu (Ryc. 3b).
Szmery u kotów z HCM są często dynamiczne, co oznacza, że ich intensywność bywa zmienna, a czasem nawet mogą nie występować. Stopień zawężania jest prawdopodobnie większy, gdy serce kurczy się z większą siłą (tj. przy zwiększonym poziomie katecholamin w sytuacjach stresowych), powodując głośniejszy szmer.; |
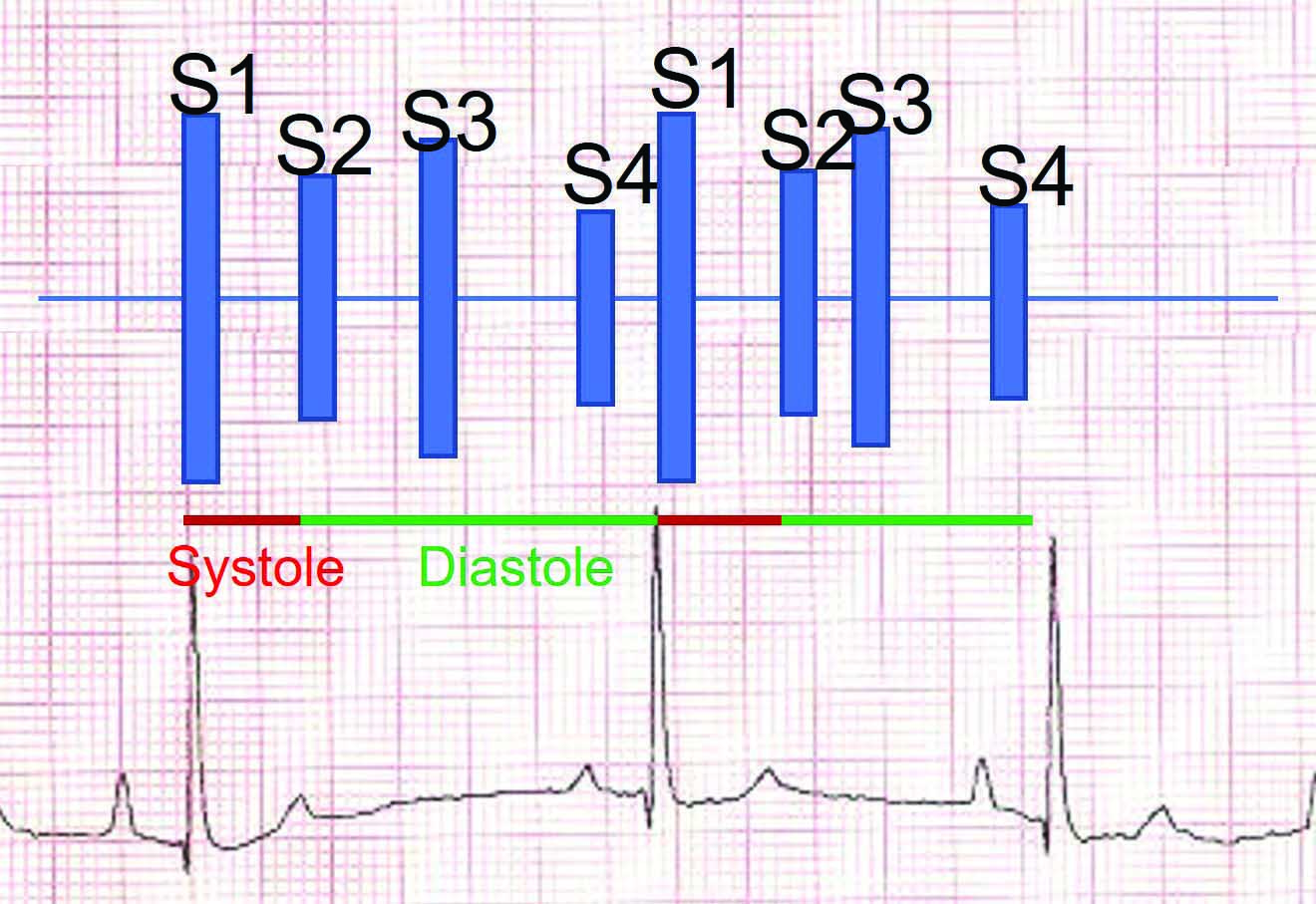
Ramka 3. Czym jest rytm cwałowy serca?
|
U większości zdrowych kotów i psów podczas badania osłuchowego wykrywany jest tylko pierwszy i drugi ton serca (S1 i S2). Rytmem cwałowym serca nazywamy charakterystyczny trójtaktowy rytm, przypominający osłuchowo cwał konia. Może to być spowodowane słyszalnym trzecim (S3) lub czwartym (S4) tonem serca, chociaż często trudno jest je rozróżnić podczas osłuchiwania. S3 jest wynikiem szybkiego napełniania komór we wczesnej fazie rozkurczu, natomiast S4 jest wynikiem aktywnego napełniania komór poprzez skurcz przedsionków w późnej fazie rozkurczu.
Rytm cwałowy serca w badaniu osłuchowym wskazuje często na obecność dysfunkcji rozkurczowej, przy czym stwierdza się go u 2,6-19% kotów z subkliniczną postacią HCM 19
. U zdrowych kotów rytm cwałowy słyszalny jest rzadko, więc jego wykrycie powinno zawsze skłaniać do wykonania dalszych badań kardiologicznych.
|
Źródło: Catheryn Partington – Joanna Dukes-McEwan
Echokardiografia
W rozpoznawaniu HCM u kotów złotym standardem jest badanie echokardiograficzne 14
,a w razie stwierdzenia przerostu należy ustalić, czy nie rozwija się on wtórnie do innej choroby. Wykonanie echokardiografii zaleca się u wszystkich kotów z objawami klinicznymi, które można przypisać kardiomiopatii (omdlenia, nietolerancja wysiłkowa, nietolerancja płynoterapii dożylnej), kotów z rodzinną historią HCM (lub nagłej śmierci sercowej), kotów rasowych przeznaczonych do rozrodu oraz kotów, u których wyniki badania fizykalnego sugerują kardiomiopatię (rytm cwałowy serca, arytmie, szmery, oddech przyspieszony, duszność, stłumione szmery oddechowe).
Konsensus ACVIM zaleca ponadto, aby ocenę echokardiograficzną przeprowadzać również u kotów w wieku powyżej 9 lat poddawanych procedurom, które mogą wywołać zastoinową niewydolność serca (np. znieczulenie ogólne, płynoterapia dożylna i długotrwała terapia kortykosteroidami) 14
.
U kotów bezobjawowych istnieją cztery główne kryteria oceny echokardiograficznej: grubość ścian lewej komory, wielkość lewego przedsionka, obecność LVOTO i funkcja rozkurczowa. Pierwsze dwa są stosunkowo łatwe do oceny przez lekarza pierwszego kontaktu z podstawowymi kompetencjami echokardiograficznymi w przypadkach choroby o nasileniu od umiarkowanego do ciężkiego.
1. Grubość ścian lewej komory
Należy ocenić zarówno przegrodę międzykomorową, jak i ścianę wolną komory lewej, na podstawie dwuwymiarowych obrazów echokardiograficznych w prawostronnych projekcjach przymostkowych w końcowej fazie rozkurczu (klatka bezpośrednio przed zamknięciem płatków zastawki mitralnej) (Ryc. 4a). Ponieważ przerost może być ogniskowy, pomiary należy wykonywać w ciągu co najmniej trzech cykli pracy serca, najlepiej z wielu projekcji. Należy uważać, aby w pomiarach ściany nie uwzględnić mięśni brodawkowatych lub obszarów z wyraźnym pogrubieniem wsierdzia. Za prawidłowe wartości końcoworozkurczowej grubości ścian lewej komory uznaje się te poniżej 5 mm, a wartości powyżej 6 mm za świadczące o przeroście. 14
Wartości w przedziale od 5 do 6 mm pozostają w szarej strefie i należy je rozważać w kontekście masy ciała, rasy kota oraz innych zmiennych echokardiograficznych 16
.

Ryc. 4a. Echokardiograficzna ocena kardiomiopatii przerostowej (HCM). (a) Projekcja prawostronna przymostkowa w osi długiej pięciojamowa. Pomiar grubości ściany wolnej komory lewej i przegrody międzykomorowej wykonuje się na podstawie obrazów dwuwymiarowych w rozkurczu; wartości ≥ 6 mm świadczą o przeroście.
Źródło: Catheryn Partington – Joanna Dukes-McEwan
2. Wielkość lewego przedsionka
Wielkość lewego przedsionka jest niezależnym czynnikiem ryzyka wystąpienia CHF, TE i zgonu sercowego. Może być oceniana w prawostronnej projekcji przymostkowej, zarówno w osi długiej, jak i krótkiej. Na projekcjach w osi krótkiej na poziomie podstawy serca dokonuje się pomiarów we wczesnej fazie rozkurczu (bezpośrednio po zamknięciu płatków zastawki aortalnej), indeksując średnicę przedsionka do aorty (LA/Ao; Ryc. 4b). Aortę mierzy się od środka wypukłej krzywizny ściany prawej zatoki aorty do punktu, w którym łączą się ściana aorty z płatkiem wieńcowym lewym i niewieńcowym. Lewy przedsionek mierzy się od tego ostatniego punktu do ściany wolnej lewego przedsionka, unikając wejścia do żyły płucnej 17
.

Ryc. 4b. Echokardiograficzna ocena kardiomiopatii przerostowej (HCM). Projekcja prawostronna przymostkowa w osi krótkiej na poziomie podstawy serca. Wielkość lewego przedsionka jest indeksowana do opuszki aorty (LA/Ao), mierzona we wczesnym rozkurczu; wartości > 1,6 świadczą o rozszerzeniu lewego przedsionka.
Źródło: Catheryn Partington – Joanna Dukes-McEwan
Pomiaru średnicy lewego przedsionka (LAD, left atrial diameter) dokonuje się w projekcji prawostronnej przymostkowej czterojamowej w osi długiej zoptymalizowanej na lewy przedsionek, w końcowej fazie skurczu (bezpośrednio przed otwarciem płatka zastawki mitralnej), rysując linię równoległą do pierścienia mitralnego, biegnącą od przegrody międzyprzedsionkowej do ściany wolnej lewego przedsionka (Ryc. 4c)18
. Lewy przedsionek uważa się za powiększony przy wartościach pomiaru LA/Ao > 1,6 oraz LAD > 16,0 mm; wartości LA/Ao > 1.8-2.0 lub LAD > 18-19 mm świadczą o średnim do ciężkiego powiększeniu lewego przedsionka. W celu oceny funkcji skurczowej można zbadać też frakcję skracania lewego przedsionka. Subiektywna ocena wielkości uszka lewego przedsionka, obecność spontanicznego echokontrastu lub skrzepliny oraz ocena prędkości przepływu przez uszko lewego przedsionka są również istotne w określeniu stopnia ryzyka wystąpienia CHF i TE.

Ryc. 4c. Echokardiograficzna ocena kardiomiopatii przerostowej (HCM). Projekcja prawostronna przymostkowa w osi długiej czterojamowa. Średnicę lewego przedsionka mierzy się równolegle do pierścienia mitralnego w końcowej fazie skurczu; wartości> 16,0 mm świadczą o powiększeniu lewego przedsionka.
Źródło: Catheryn Partington – Joanna Dukes-McEwan
Skróty: Ao – aorta; IVS – przegroda międzykomorowa; LA – lewy przedsionek; LV – lewa komora; LVFW – ściana wolna lewej komory serca; MV – zastawka mitralna.
3. Zawężenie drogi odpływu lewej komory (LVOTO)
Parametr ten można ocenić przy pomocy takich technik i metod pomiarowych jak: obrazowanie jednowymiarowe (M-mode), dwuwymiarowe (2D), obrazowanie przy zastosowaniu dopplera kolorowego i spektralnego (Ryc. 3c). Skurczowy ruch przedniego płatka zastawki mitralnej do przodu (SAM) można wizualizować zarówno w trybie jedno- i dwuwymiarowym. Badanie techniką kolorowego dopplera wykaże turbulentny skurczowy przepływ przez drogę ujścia z lewej komory i ewentualnie niedomykalność zastawki mitralnej. Ocena prędkości przepływu z użyciem dopplera spektralnego wymaga dobrego ustawienia wiązki ultrasonograficznego do przepływu; przy zawężeniu dynamicznym wykres dopplerowski często uwidacznia przyspieszenie dwufazowe (charakterystyczny przepływ w kształcie sztyletu).
4. Funkcja rozkurczowa
Funkcję rozkurczową można ocenić zarówno z użyciem techniki dopplera spektralnego, jak i tkankowego, dalsza dyskusja na ten temat wykracza jednak poza zakres tego artykułu. Koty z zaawansowaną postacią HCM mogą mieć również upośledzoną funkcję skurczową.
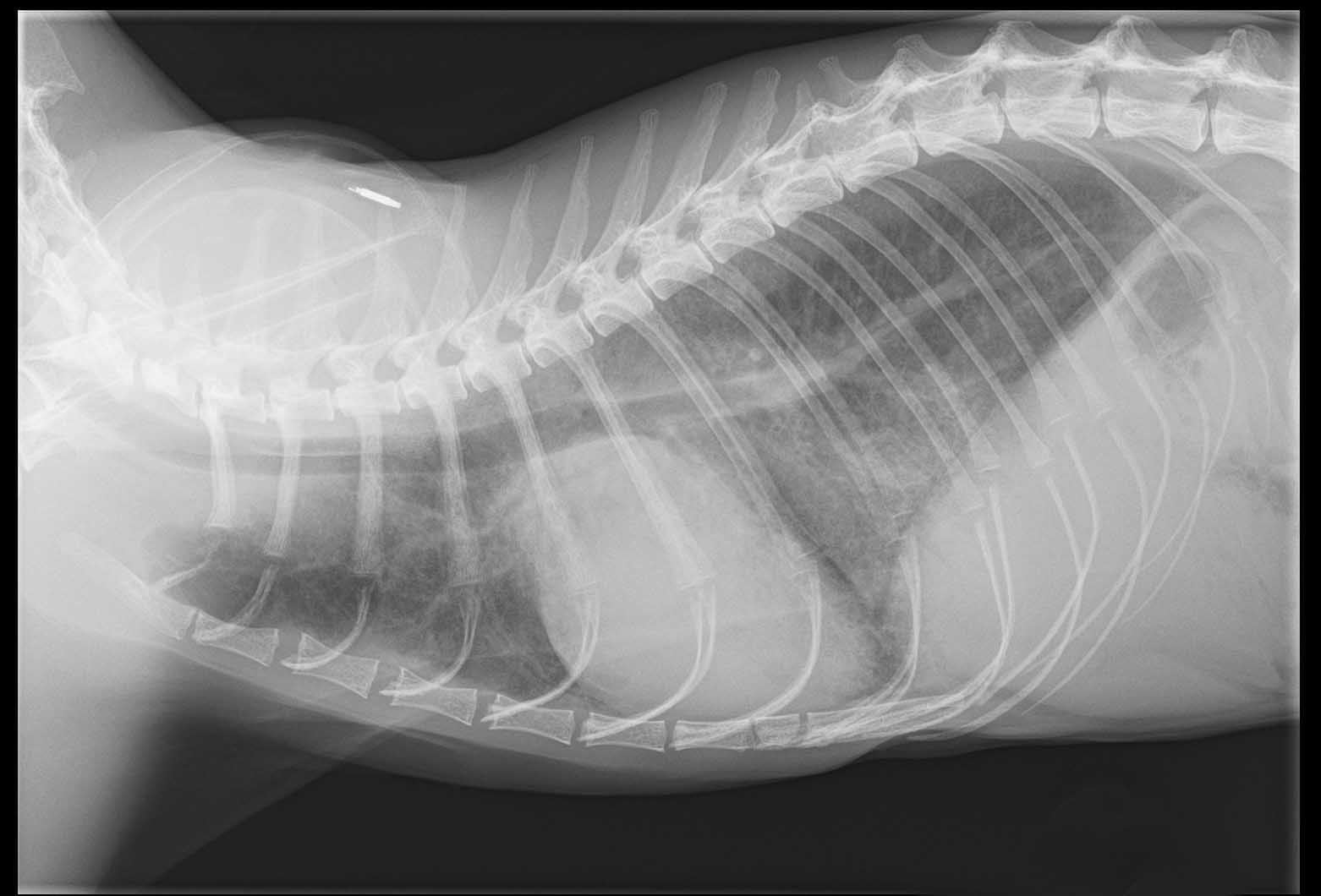
Radiografia
Badanie radiograficzne klatki piersiowej uważa się za złoty standard w rozpoznaniu obrzęku płuc, u kotów bezobjawowych jest jednak mniej przydatne 14
. Można zaobserwować ciężką kardiomegalię z uwypukleniem lewego przedsionka, jednak radiogramy mają niższą czułość w wykrywaniu łagodnego lub umiarkowanego przerostu u pacjentów z HCM, z których wielu może mieć prawidłową sylwetkę serca.
Biomarkery sercowe
Biomarkery zostaną omówione bardziej szczegółowo w osobnym artykule, ale mówiąc w skrócie, oznaczenie ich stężenia może być przydatnym uzupełnieniem innych badań diagnostycznych i narzędziem do monitorowania postępu choroby. Należy zachować ostrożność przy zastosowaniu tego badania jako badania przesiewowego. W przypadku kotów bezobjawowych oznaczanie ilościowe NT-proBNP (marker przeciążenia i rozciągnięcia mięśnia sercowego) ma ograniczone zastosowanie jako narzędzie przesiewowe w populacji ogólnej, ponieważ mimo wysokiej swoistości, cechuje je niska czułość, co oznacza wysokie ryzyko uzyskania wyników fałszywie ujemnych. Bardziej zasadne wydaje się wykonanie takiego badania selektywnie, u osobników z podejrzeniem kardiomiopatii (tj. w przypadku wykrycia szmerów)19
oraz wraz z echokardiografią w celu dokładniejszego określenia stopnia zaawansowania choroby. Szybki test diagnostyczny (zwany też testem przyłóżkowym) można wykonać u kotów objawowych w celu rozróżnienia sercowych i pozasercowych przyczyn duszności 20
.
Przydatnym uzupełnieniem echokardiografii jest też badanie stężenia troponiny sercowej I (Tn I) będącej markerem uszkodzenia kardiomiocytów. Wykazano, że poziom Tn I ma znaczenie prognostyczne, a zwiększone wartości wiążą się z gorszymi rokowaniami 21
. Niedokrwienie mięśnia sercowego może skutkować wysokim stężeniem Tn I, który stwierdza się u kotów w zaawansowanym stadium HCM. Istotny wzrost stężenia Tn I może sugerować zapalenie mięśnia sercowego i wtórny obraz fenotypowej HCM, co uzasadnia dalsze badania.
Wykazano, że stężenia obu biomarkerów są wyższe u kotów z HCM i SAM niż u kotów z HCM bez SAM, nawet u osobników z prawidłową/niejednoznaczną wielkością lewego przedsionka 22
.
Testy genetyczne
Badania w kierunku mutacji genetycznych są dostępne dla kotów rasy maine coon, ragdoll i sfinks (Ryc. 5). Zaleca się wykonanie takich badań u wszystkich osobników przeznaczonych do rozrodu w celu ograniczenia występowania dziedzicznej HCM w obrębie predysponowanych ras. Z hodowli powinny być wykluczone osobniki homozygotyczne pod względem mutacji, natomiast heterozygoty można krzyżować z osobnikami ujemnymi pod względem mutacji 14
. Jednak ważne jest, aby hodowcy byli świadomi, że HCM może wystąpić też u kotów bez znanych mutacji genetycznych.

Ryc. 5. Lekarze weterynarii w lecznicach pierwszego kontaktu powinni być wyczuleni na objawy HCM u swoich pacjentów. Badania kliniczne kotów powinny każdorazowo obejmować staranne osłuchiwanie serca pod kątem obecności szmerów, rytmu cwałowego i arytmii, a stwierdzenie któregokolwiek z wymienionych objawów wymaga dalszej diagnostyki. Dotyczy to zwłaszcza kotów ras predysponowanych. Obecnie dostępne są testy wykrywające mutację genetyczną, która może być odpowiedzialna za HCM u kotów rasy sfinks.
Źródło: Shutterstock
Leczenie
Określenie stopnia zaawansowania kardiomiopatii przerostowej u kotów może pomóc w ustandaryzowaniu sposobu leczenia. U kotów w stadium A i B1 (brak/minimalne poszerzenie lewego przedsionka) nie należy wprowadzać leczenia farmakologicznego, z wyjątkiem przypadków ciężkiego zawężenia drogi odpływu lewej komory, w których można rozważyć zastosowanie beta-adrenolityków (patrz poniżej). W stadium B2 rośnie ryzyko wystąpienia choroby zatorowo-zakrzepowej, dlatego w ramach leczenia zapobiegawczego warto zastosować wówczas klopidogrel.
Podobnie jak w przypadku kardiomiopatii przerostowej u ludzi, wykazano, że w patogenezie tej choroby u kotów uczestniczy prawdopodobnie insulina, insulinopodobny czynnik wzrostu-1 i stan zapalny. Zmiany diety ukierunkowane na te czynniki mogą mieć zatem korzystne skutki; jedno z niedawnych badań wykazało zmniejszoną przebudowę lewej komory serca u kotów w subklinicznym stadium HCM będących na diecie niskoskrobiowej wzbogaconej kwasami tłuszczowymi omega-3. Jedną z opcji do rozważenia w ramach postępowania dietetycznego u pacjentów w stadium B są dostępne już na rynku gotowe weterynaryjne karmy przeznaczone dla kotów z chorobami serca 23
.
Wśród osób z HCM i ciężkim LVOTO często zgłaszanymi objawami są nietolerancja wysiłkowa i dusznica bolesna, a poprawę notuje się po wdrożeniu leczenia beta-adrenolitykami. Stosowanie ich u kotów w stadium subklinicznym z potwierdzonym LVOTO pozostaje dyskusyjne, a autorzy zalecają, aby przed ewentualnym podjęciem takiej decyzji skierować pacjenta na konsultację kardiologiczną. Teoretycznie leki beta-adrenolityczne wydają się być korzystne w przypadku ciężkiego LVOTO; ujemne działanie inotropowe i chronotropowe może zmniejszać nasilenie zawężania, jednocześnie poprawiając zaopatrzenie mięśnia sercowego w tlen, zmniejszając ryzyko zaburzeń rytmu i niedokrwienia. Nie udowodniono jednak żadnych korzyści w postaci zwiększonej przeżywalności ani poprawy jakości życia 24
,25
. Ponadto beta-adrenolityki są przeciwwskazane w przypadkach zastoinowej niewydolności serca i prawdopodobnie byłyby szkodliwe dla kotów bliskich dekompensacji.
Wyzwaniem związanym z HCM jest zmienna długość fazy subklinicznej oraz częsty brak jakichkolwiek objawów klinicznych lub zmian w badaniu fizykalnym.
Joanna Dukes-McEwan
Wniosek
Biorąc pod uwagę, że HCM występuje u kotów z dużą częstością, z tendencją do długiej fazy subklinicznej i ryzykiem wystąpienia poważnych objawów klinicznych, lekarz pierwszego kontaktu powinien zwracać uwagę na objawy choroby w stadium B u swoich kocich pacjentów. Wszystkie badania kotów powinny obejmować staranne osłuchiwanie serca pod kątem obecności szmerów, rytmu cwałowego i arytmii, a stwierdzenie któregokolwiek z wymienionych objawów wymaga dalszej diagnostyki. Wykrycie choroby w stadium B pozwala wdrożyć stosowne leczenie zapobiegawcze, a także zmniejszyć ryzyko dekompensacji układu krążenia poprzez modyfikowanie i ścisłe monitorowanie terapii, które mogą przyczyniać się do jej wystąpienia. Większa świadomość i czujność opiekuna mogą również ułatwić wykrycie zastoinowej niewydolności serca przed wystąpieniem ciężkiego upośledzenia oddechowego.
Bibliografia
-
Payne JR, Brodbelt DC, Luis Fuentes V. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J. Vet. Cardiol. 2015;17 Suppl 1:S244-S257.
-
Fox PR, Keene BW, Lamb K, et al. International collaborative study to assess cardiovascular risk and evaluate long-term health in cats with preclinical hypertrophic cardiomyopathy and apparently healthy cats: the REVEAL study. J. Vet. Intern. Med. 2018;32:930-943.
-
Kittleson MD, Cote E. The feline cardiomyopathies: 2. Hypertrophic Cardiomyopathy. J. Feline Med. Surg. 2021;23:1028-1051.
-
Cote E, MacDonald KA, Meurs KM, et al. Hypertrophic Cardiomyopathy. In: Feline Cardiology. 1st ed. John Wiley & Sons, Inc. 2011 Chapter 11;101-175.
-
Meurs KM, Sanchez X, David RM, et al. A cardiac myosin binding protein C mutation in the Maine Coon cat with familial hypertrophic cardiomyopathy. Hum. Mol. Genet. 2005;14:3587-3593.
-
Meurs KM, Norgard MM, Ederer MM, et al. A substitution mutation in the myosin binding protein C gene in Ragdoll hypertrophic cardiomyopathy. Genomics 2007;90:261-264.
-
Meurs KM, Williams BG, de Prospero D, et al. A deleterious mutation in the ALMS1 gene in a naturally occurring model of hypertrophic cardiomyopathy in the Sphynx cat. Orphanet J. Rare Dis. 2021;16:108.
-
Kittleson MD, Meurs KM, Harris SP. The genetic basis of hypertrophic cardiomyopathy in cats and humans. J. Vet. Cardiol. 2015;17 Suppl 1:S53-S73.
-
Schober K, Todd A. Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2010;12:1e16.
-
Seo J, Novo Matos J, Payne JR, et al. Anterior mitral valve leaflet length in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2021;37:62-70.
-
Maron BJ, Maron MS. A discussion of contemporary nomenclature, diagnosis, imaging, and management of patients with hypertrophic cardiomyopathy. Am. J. Cardiol. 2016;118:1897-1907.
-
MacLea HB, Boon JA, Bright JM. Doppler echocardiographic evaluation of mid ventricular obstruction in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2013;27:1416-1420.
-
Novo Matos J, Pereira N, Glaus T, et al. Transient myocardial thickening in cats associated with heart failure. J. Vet. Intern. Med. 2018;32(1):48-56.
-
Luis Fuentes V, Abbott J, Chetboul V, et al. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J. Vet. Intern. Med. 2020;34:1062-1077.
-
Payne JR, Borgeat K, Connolly DJ, et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2013;27:1427-1436.
-
Haggstrom J, Andersson AO, Falk T, et al. Effect of body weight on echocardiographic measurements in 19,866 pure-bred cats with or without heart disease. J. Vet. Intern. Med. 2016;30:1601-1611.
-
Hansson K, Haggstrom J, Kvart C, et al. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in Cavalier King Charles Spaniels with and without left atrial enlargement. Vet. Radiol. Ultrasound 2002;43(6):569-575.
-
Linney CJ, Dukes-McEwan J, Stephenson HM, et al. Left atrial size, atrial function and left ventricular diastolic function in cats with hypertrophic cardiomyopathy. J. Small. Anim. Pract. 2014;55(4):198-206.
-
Fox PR, Rush JE, Reynolds CA, et al. Multicenter evaluation of plasma N-terminal probrain natriuretic peptide (NT-pro BNP) as a biochemical screening test for asymptomatic (occult) cardiomyopathy in cats. J. Vet. Intern. Med. 2011;25:1010-1016.
-
Ward JL, Lisciandro GR, Ware WA, et al. Evaluation of point-of-care thoracic ultrasound and NT-proBNP for the diagnosis of congestive heart failure in cats with respiratory distress. J. Vet. Intern. Med. 2018;32:1530-1540.
-
Borgeat K, Sherwood K, Payne J, et al. Plasma cardiac troponin I concentration and cardiac death in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2014;28:1731-1737.
-
Seo J, Payne JR, Novo Matos J, et al. Biomarker changes with systolic anterior motion of the mitral valve in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2020;34(5):1718-1727.
-
van Hoek I, Hodgkiss-Geere H, Bode EF, et al. Association of diet with left ventricular wall thickness, troponin I and IGF-1 in cats with subclinical hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2020;34(6):2197-2210.
-
Schober KE, Zientek J, Li X, et al. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J. Vet. Cardiol. 2013;15:93-104.
-
Coleman AE, DeFrancesco TC, Griffiths EH, et al. Atenolol in cats with subclinical hypertrophic cardiomyopathy: a double-blind, placebo-controlled, randomized clinical trial of effect on quality of life, activity, and cardiac biomarkers. J. Vet. Cardiol. 2020;30:77-91.
Catheryn Partington
Dr. Partington graduated from the University of Liverpool in 2014, having also attained a Masters in Veterinary Science, and returned to the University for both her rotating internship and cardiology residency, completing the latter in 2021 Przeczytaj więcej
Joanna Dukes-McEwan
Professor Dukes-McEwan graduated in 1986 from the University of Glasgow and remained there to do an internship and residency training Przeczytaj więcej