Vermes pulmonares y cardiacos en el gato
Las infecciones por nematodos pulmonares y cardiacos representan una amenaza y, aunque se subestimen, son potencialmente graves para muchos gatos, tal y como revela este artículo.
Número de edición 32.2 Cardiología
Fecha de publicación 13/10/2022
Disponible también en Français , Deutsch , Italiano , Polski , Română y English
La cardiomiopatía hipertrófica es una enfermedad frecuente en gatos de compañía, pero su identificación puede no ser sencilla; este artículo ofrece una visión general de la enfermedad útil para el veterinario generalista.

La cardiomiopatía hipertrófica (CMH) es la cardiomiopatía de mayor prevalencia en gatos y se caracteriza por la hipertrofia del ventrículo izquierdo y la disminución de la función diastólica.
Ante la auscultación de un soplo, arritmia o sonido compatible con ritmo de galope en un gato asintomático siempre está justificado realizar una investigación cardiaca más detallada.
La ecocardiografía es la prueba diagnóstica de referencia, siendo el tamaño de la aurícula izquierda un importante indicador pronóstico.
La progresión de la CMH es variable y la fase preclínica suele ser larga; la estadificación proporciona información sobre el pronóstico y permite valorar la necesidad de tratar o de modificar el manejo del paciente.
La cardiomiopatía hipertrófica (CMH) felina es una enfermedad primaria del miocardio definida por la hipertrofia concéntrica del ventrículo izquierdo (VI), es decir, el engrosamiento de las paredes del VI 1. Es una enfermedad caracterizada por la disfunción diastólica (alteración de la relajación), normalmente, con una función sistólica (contractilidad) preservada. La menor capacidad de distensión del miocardio reduce la capacidad de relajación y llenado durante la diástole, con el consiguiente aumento de la presión diastólica, dando lugar a la dilatación progresiva de la aurícula izquierda (AI) 2. El diagnóstico de CMH se realiza por exclusión, por lo que es necesario descartar otras posibles enfermedades cardiacas o sistémicas que puedan causar o contribuir al fenotipo de CMH, como la hipertensión sistémica, el hipertiroidismo, la acromegalia y la estenosis aórtica. La progresión de la enfermedad es muy variable y a menudo existe una fase asintomática, preclínica, prolongada que frecuentemente no se detecta. Posteriormente, los gatos afectados pueden presentar signos de fallo cardiaco congestivo (FCC), tromboembolismo arterial (TE) o arritmias 2,3.
La CMH es la cardiomiopatía más frecuente en el gato y se estima que afecta al 14,5-34% de los gatos “sanos” 1,4. La mayoría de los gatos afectados son domésticos de pelo corto o largo 4, pero entre los gatos de raza con mayor predisposición se encuentra el Persa, el British Shorthair, el Maine Coon, el Ragdoll, el Sphynx, el Himalaya y el Bengalí. Puede afectar a gatos de cualquier edad, pero en particular, los gatos de raza pueden desarrollar una enfermedad grave a una edad temprana 4. Existe una mayor sobrerrepresentación en el macho, con un 75% de los casos, a pesar de que no se ha identificado un patrón hereditario ligado al sexo.
Catheryn Partington
La CMH familiar en el Maine Coon, Ragdoll y Sphynx 5,6,7 se debe a mutaciones en las proteínas del sarcómero, pero en los demás casos, la causa sigue siendo desconocida, aunque probablemente en otras razas sea hereditaria. El sarcómero es el elemento contráctil de los cardiomiocitos, de manera que las mutaciones en proteínas sarcoméricas alteran su estructura y funcionalidad, lo que, en última instancia, da lugar a la deficiente contractilidad del cardiomiocito. El mecanismo exacto por el que la desregulación del sarcómero conduce al fenotipo de la CMH es complejo y no se conoce del todo. La alteración en la sensibilidad al calcio, la función mecánica y el estrés celular conducen a la hipertrofia de los miocitos, la síntesis de colágeno y la desorganización de los miocitos, que son características histopatológicas de la CMH felina 4,8.
En el Maine Coon y en el Ragdoll se han identificado dos mutaciones diferentes en la proteína C de unión a la miosina en el sarcómero (A31P y R820W, respectivamente) 5,6. Los individuos heterocigotos para dichas mutaciones suelen presentar una enfermedad subclínica, con alteraciones a nivel celular, no macroscópicas, pero los homocigotos desarrollan la enfermedad de forma más grave; se sospecha un modo de herencia de dominancia incompleta. Los gatos de raza Maine Coon que no tienen la mutación también pueden desarrollar un fenotipo de CMH, lo que refleja la probable etiología multifactorial de la enfermedad. Recientemente se ha identificado una mutación en el gen ALMS1* como factor causal de CMH en el gato Sphynx 7.
* ALMS1 = Síndrome de Alström 1
Como se ha mencionado anteriormente, la CMH se manifiesta como una hipertrofia del VI acompañada de disfunción diastólica, de manera que las alteraciones patológicas que tienen lugar reducen la capacidad del ventrículo de relajarse y llenarse durante la diástole. Además, la hipertrofia progresiva de la pared reduce el aporte sanguíneo a los cardiomiocitos y, a medida que estos mueren, son sustituidos por tejido fibroso, lo que reduce aún más la capacidad de distensión del miocardio al aumentar su rigidez. Por tanto, se produce un aumento de la presión diastólica del VI para cualquier volumen de sangre dado, lo que provoca un aumento de la presión en la AI, que dará lugar a su agrandamiento. La elevada presión de la AI se transmite de forma retrógrada a las venas pulmonares y, si la presión venosa pulmonar supera los 25 mmHg, se producirá un edema pulmonar característico de FCC izquierdo 4. En el gato, las venas que drenan la pleura se abren a las venas pulmonares, por lo que se puede desarrollar un derrame pleural con FCC izquierdo (en el perro el derrame pleural siempre se debe a un FCC derecho, nunca izquierdo) 4.
El agrandamiento progresivo de la AI es uno de los factores que predisponen a los gatos con CMH grave a la enfermedad tromboembólica, aunque esta afección queda fuera del alcance del artículo. La hipertrofia marcada, la disminución del aporte de oxígeno y la fibrosis de sustitución dentro del miocardio favorecen el desarrollo de arritmias.
La hipertrofia del VI en la CMH felina puede afectar tanto al septo interventricular como a la pared libre, o pueden producirse alteraciones asimétricas que afecten únicamente a una región, normalmente, la base del septo interventricular. La hipertrofia también puede afectar al ventrículo derecho, pero el patrón y la distribución varían mucho de un individuo a otro (Figuras 1 y 2) 4. También pueden producirse alteraciones en el aparato mitral, incluyendo la elongación de la valva anterior de la válvula mitral y la hipertrofia de los músculos papilares. El movimiento sistólico anterior (MSA) de la válvula mitral es un hallazgo frecuente de la CMH y puede causar una importante obstrucción del tracto de salida del ventrículo izquierdo (OTSVI) 9,10.


Figura 1. En la cardiomiopatía hipertrófica, el patrón de la hipertrofia del ventrículo izquierdo puede variar mucho de un individuo a otro, pero en estas dos muestras de anatomía patológica se puede observar macroscópicamente una hipertrofia difusa del ventrículo izquierdo.
Abreviaturas: LVFW, pared libre del ventrículo izquierdo; IVS, septo interventricular; RV, ventrículo derecho.
Cortesía de Emanuele Ricci, Universidad de Liverpool, RU

Figura 2a. Las vistas ecocardiográficas de la CMH pueden mostrar una gran variabilidad. (a) Vista paraesternal derecha en eje largo de 5 cámaras que muestra una hipertrofia focal que afecta al septo basal (*).
Credit: Catheryn Partington – Joanna Dukes-McEwan

Figura 2b. Las vistas ecocardiográficas de la CMH pueden mostrar una gran variabilidad. Vista paraesternal derecha, en eje corto, a nivel de los músculos papilares que muestra hipertrofia del ventrículo izquierdo y de los músculos papilares.
Credit: Catheryn Partington – Joanna Dukes-McEwan

Figura 2c. Las vistas ecocardiográficas de la CMH pueden mostrar una gran variabilidad. Vista paraesternal derecha en eje largo de 4 cámaras que muestra una hipertrofia simétrica del septo interventricular y de la pared libre del ventrículo izquierdo.
Credit: Catheryn Partington – Joanna Dukes-McEwan
Abreviaturas: LA, aurícula izquierda; LV, ventrículo izquierdo; Pm, músculo papilar.
Es posible que un subgrupo de gatos con CMH desarrolle una OTSVI significativa (Figura 3). En estos casos, clásicamente se habla de cardiomiopatía hipertrófica obstructiva (CMO), pero en medicina humana, este término ya no se utiliza, ya que la OTSVI puede ser intermitente y, como en gatos ocurre lo mismo, este término probablemente también esté obsoleto 3,9,11. La OTSVI puede producirse por un MSA de la válvula mitral, una hipertrofia focal del septo basal o, con menor frecuencia, una obstrucción de la parte media de la cavidad como consecuencia de la hipertrofia de los músculos papilares 4,9,12. La OTSVI causa un soplo por la mayor turbulencia de la sangre. En el caso de MSA, la obstrucción suele ser dinámica y empeora cuando aumenta la contractilidad cardiaca, como ocurre durante el estrés físico o emocional. Este suele ser el motivo de la variabilidad respecto a la presencia o la intensidad del soplo en gato con CMH.
El MSA de la válvula mitral se produce cuando la valva septal (anterior), frecuentemente elongada, es arrastrada hacia el tracto de salida como consecuencia de la hipertrofia y el desplazamiento del músculo papilar, dando lugar al debilitamiento de las cuerdas tendinosas 10. A medida que el tracto de salida se estrecha por este movimiento anormal de la valva (o por la hipertrofia del septo basal), la velocidad de la sangre aumenta y la presión disminuye, arrastrando más la punta de la valva hacia el tracto de salida y empeorando la obstrucción (efecto Venturi) 4,9. Se cree que el MSA aumenta la demanda de oxígeno del miocardio y reduce la perfusión coronaria, aumentando el riesgo de isquemia miocárdica; probablemente, este asociado a la hipertrofia progresiva y la disfunción microvascular. Se cree que algunos gatos con OTSVI grave muestran signos de menor capacidad de ejercicio y de dolor tipo angina, como el descrito en las personas.

Figura 3a. En los gatos con CMH, el soplo normalmente se debe a la obstrucción del tracto de salida del ventrículo izquierdo (OTSVI). Vista paraesternal derecha en eje largo de 5 cámaras con Doppler color que muestra una turbulencia de flujo sanguíneo en el tracto de salida del ventrículo izquierdo (flecha abierta) causado por el movimiento sistólico anterior de la válvula mitral y un pequeño jet excéntrico de regurgitación mitral (flecha pequeña).
Credit: Catheryn Partington – Joanna Dukes-McEwan

Figura 3b. En los gatos con CMH, el soplo normalmente se debe a la obstrucción del tracto de salida del ventrículo izquierdo (OTSVI). Vista paraesternal derecha en eje largo de 5 cámaras que muestra hipertrofia septal basal focal (*) como causa de OTSVI.
Credit: Catheryn Partington – Joanna Dukes-McEwan

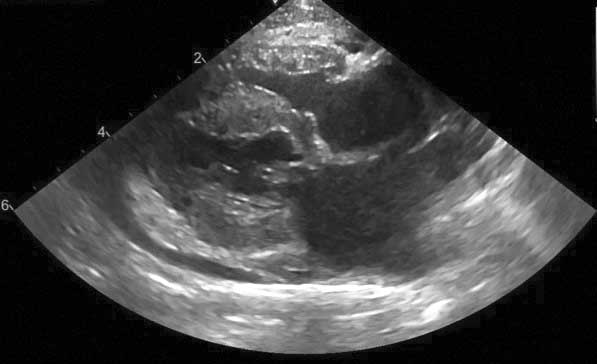
Figura 3c. En los gatos con CMH, el soplo normalmente se debe a la obstrucción del tracto de salida del ventrículo izquierdo (OTSVI). Doppler espectral del TSVI que muestra un aumento de las velocidades (*) y una aceleración bifásica (típica forma de “sable”), indicativa de OTSVI.
Cortesía de J. Novo Matos, Universidad de Cambridge, RU
Abreviaturas: Ao, aorta; LA, aurícula izquierda; LV ventrículo izquierdo
Es importante incluir el engrosamiento miocárdico transitorio (EMT) en el diagnóstico diferencial del fenotipo de CMH. El EMT es raro y poco conocido y se caracteriza por un aumento del grosor de la pared del VI y una dilatación de la AI, menos evidente que la de la CMH primaria. Tanto los signos clínicos como las alteraciones ecocardiográficas se resuelven completamente al cabo de unos meses. Por tanto, el EMT está asociado con un pronóstico excelente. Los gatos con FCC secundario al EMT suelen ser más jóvenes que los que padecen una CMH primaria y en su historial muchas veces se hace referencia algún acontecimiento previo (como una anestesia general). Se ha postulado que el engrosamiento de la pared puede deberse a un edema miocárdico, guardando similitudes tanto con la miocarditis aguda como con la cardiomiopatía inducida por el estrés de las personas 13.
En las recientes recomendaciones según el consenso del ACVIM para el diagnóstico y el tratamiento de la CMH 14 se describe un sistema de estadificación, similar al de la enfermedad mixomatosa de la válvula mitral en el perro (Recuadro 1). Este sistema puede ayudar a determinar si el tratamiento está indicado y a proporcionar algunas expectativas para los cuidadores, ya que la progresión de la CMH y, por tanto, el pronóstico, es muy variable. En algunos gatos, la enfermedad progresa hacia FCC, TE y muerte súbita de origen cardiaco, mientras que en otros la enfermedad se mantiene en fase preclínica y los gatos finalmente fallecen por causas no cardiacas 14,15. El motivo de esta heterogeneidad sigue sin estar claro y es difícil predecir qué gatos sucumbirán a la enfermedad, aunque en varios estudios retrospectivos se han identificado varios factores pronósticos. Los gatos que se diagnostican a una edad más temprana suelen tener una mayor supervivencia 2. Los gatos que desarrollan FCC secundario a factores como el estrés o la fluidoterapia intravenosa (IV) suelen tener una mayor supervivencia que los gatos con CMH en estadio C. La presencia de sonidos compatibles con ritmo de galope, arritmias, dilatación importante de la AI, reducción de la función sistólica de la AI, contraste ecográfico espontáneo, hipertrofia grave de la pared (>9 mm), disfunción sistólica del VI y adelgazamiento focal de la pared están asociados con un mayor riesgo de FCC y/o TE 2,15.
Recuadro 1. Estadificación de la CMH felina según el ACVIM.
 |
Estadio A |
Estadio A: gatos predispuestos, pero sin evidencias de CMH; p.ej., Maine Coon con la mutación A31P o gato con un pariente cercano diagnosticado de CMH. El corazón es estructuralmente normal en la exploración ecográfica. |
 |
Estadio B1 |
Estadio B: gatos con CMH preclínica (sin signos clínicos, pero con evidencias ecocardiográficas de CMH). Este estadio se subdivide a su vez en función de la gravedad y riesgo de FCC y TE.
• Estadio B1: riesgo de FCC y TE bajo, con una AI normal o dilatación leve
• Estadio B2: riego inminente de FCC o TE elevado, con dilatación de la AI de moderada a grave.
|
 |
Estadio B2 | |
 |
Estadio C | Estadio C: gatos con signos clínicos de CMH y FCC o TE. |
 |
Estadio D |
Estadio D: gatos con CMH con FCC refractario al tratamiento.
|
Credit: Catheryn Partington
Debido a la disfunción diastólica y la consiguiente elevación de la presión en el VI para cualquier volumen de sangre, los gatos con CMH son más sensibles al aumento del volumen circulante (es decir, al aumento de la precarga). Ciertos tratamientos, como el uso prolongado de corticoides y la fluidoterapia IV, podrían favorecer que un gato con CMH avanzada progresara hacia un FCC izquierdo. Esto subraya la importancia de identificar a los gatos con enfermedad preclínica, ya que así se pueden modificar dichos tratamientos y monitorizar estrechamente al paciente (p. ej., disminuir el ritmo de fluidoterapia, controlar la frecuencia respiratoria, obtener imágenes secuenciales para evaluar el tamaño de la AI) para reducir el riesgo de descompensación. Además, los gatos con CMH avanzada tienen mayor riesgo de tromboembolismo y su identificación permite la instauración de un tratamiento antiplaquetario preventivo.
La identificación de los gatos en estadio B puede facilitar la detección de signos sutiles de progresión temprana hacia el estadio C, ya que los cuidadores, al estar mejor informados, podrán estar más atentos ante cualquier signo de FCC, permitiendo así iniciar el tratamiento antes de que se desarrolle un edema pulmonar fulminante y un compromiso respiratorio grave.
El reto de la CMH está relacionado con la elevada variabilidad de la duración de la fase preclínica y la frecuente ausencia de signos clínicos o de hallazgos en la exploración física. Entre los hallazgos de la exploración física que hacen sospechar una CMH en estadio B se incluye la auscultación de un soplo (Recuadro 2), sonido compatible con ritmo de galope (Recuadro 3) o arritmia 4. Aunque muchos gatos asintomáticos con CMH presentan un soplo, más del 31-62% no lo tienen; además, el 25-33% de los gatos con soplo sistólico paraesternal izquierdo (normalmente suave y de bajo grado) no presentan evidencias ecocardiográficas de cardiomiopatía 1,4. Los soplos más fuertes (> grado 3/6) tienen mayor probabilidad de estar asociados a una enfermedad cardiaca importante 4, pero la detección de cualquier soplo justifica una investigación adicional.
Recuadro 2. Causas de soplos en la CMH.
|
Los soplos se escuchan cuando el flujo sanguíneo se vuelve turbulento; esto puede deberse a un flujo sanguíneo de alta velocidad, a vasos de gran diámetro, a una alta densidad o a una baja viscosidad. En la CMH, los soplos suelen deberse a una obstrucción del tracto de salida del ventrículo izquierdo (OTSVI) debido al movimiento sistólico anterior de la válvula mitral y/o a la hipertrofia septal basal.
En los gatos con CMH los soplos suelen ser dinámicos, lo que significa que pueden cambiar de intensidad, e incluso a veces pueden estar ausentes. El grado de obstrucción probablemente empeora cuando el corazón se contrae con más fuerza (por aumento de las catecolaminas por estrés), creando un soplo más intenso.
|
Recuadro 3. ¿Qué son los sonidos de ritmo galope?
|
Durante la auscultación de la mayoría de los perros y gatos sanos solo se pueden detectar el primer (S1) y el segundo (S2) sonido cardiaco. El sonido de ritmo de galope es un sonido cardiaco adicional audible, que crea una cadencia de tres latidos, similar a las pisadas de un caballo galopando.
Puede deberse a un tercer (S3) o cuarto (S4) sonido cardiaco audible, aunque muchas veces es difícil diferenciarlos en la auscultación. El S3 corresponde al llenado ventricular rápido al inicio de la diástole, mientras que el S4 corresponde al llenado ventricular activo por la contracción auricular al final de la diástole.
La auscultación de sonidos de ritmo de galope suele indicar una disfunción diastólica y, entre el 2,6 y el 19% de los gatos con CMH subclínica presentan ritmo de galope 19. Es raro escuchar estos sonidos en gatos sanos por lo que su detección siempre debería llevar a una investigación cardiaca más profunda.
|
Credit: Catheryn Partington – Joanna Dukes-McEwan
La ecocardiografía es la técnica de referencia para el diagnóstico de la CMH 14 y si se detecta una hipertrofia, se deben investigar las posibles causas secundarias. Se recomienda realizar una ecocardiografía a cualquier gato con signos clínicos posiblemente atribuibles a una cardiomiopatía (síncope, intolerancia al ejercicio, intolerancia a la fluidoterapia intravenosa), gatos con antecedentes familiares de CMH (o muerte súbita), gatos de raza destinados a la cría y gatos con hallazgos en la exploración física sugestivos de cardiomiopatía (auscultación de sonido compatible con ritmo de galope, arritmias, soplo, taquipnea, distrés respiratorio, sonidos pulmonares reducidos). El consenso del ACVIM también recomienda la evaluación ecocardiográfica a los gatos de más de 9 años de edad que van a someterse a alguna intervención que pueda precipitar el FCC (p. ej., anestesia general, fluidoterapia IV, corticoterapia prolongada) 14.
En la evaluación ecocardiográfica de los gatos asintomáticos se utilizan cuatro criterios principales: el grosor de la pared del VI, el tamaño de la AI, la presencia de OTSVI y la función diastólica. Los dos primeros son relativamente fáciles de evaluar por un veterinario con conocimientos básicos de ecografía en casos de enfermedades moderadas o graves.
1. Grosor de la pared del ventrículo izquierdo
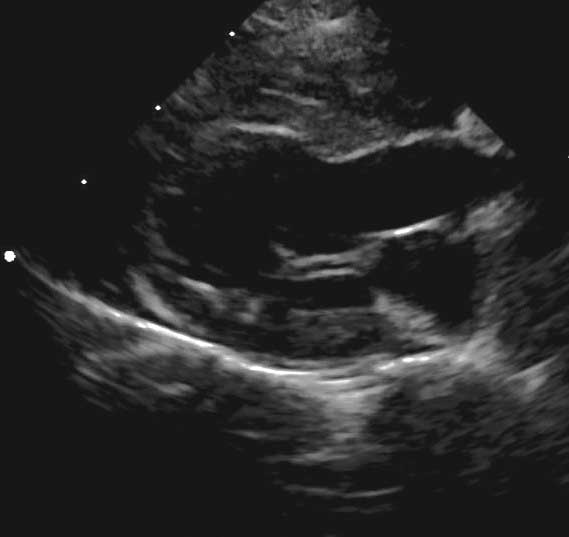
Se debe realizar una evaluación tanto del septo interventricular como de la pared libre del VI, utilizando para las mediciones el modo bidimensional en la vista paraesternal derecha al final de la diástole (antes del cierre de las valvas de la válvula mitral) (Figura 4a). Como la hipertrofia puede ser focal, las mediciones se deben realizar durante al menos tres ciclos cardiacos e, idealmente, desde múltiples localizaciones. En las mediciones de la pared se debe prestar atención para no incluir los músculos papilares o las regiones con un engrosamiento endocárdico notable. Un grosor de la pared del VI al final de la diástole inferior a 5 mm es normal, mientras que una medición de ≥ 6 mm es compatible con hipertrofia 14. Los valores entre 5-6 mm se encuentran en una zona gris y se deben valorar con respecto al tamaño corporal, la raza y otras variables ecocardiográficas 16.

Figura 4a. Evaluación ecocardiográfica de la cardiomiopatía hipertrófica (CMH). Vista paraesternal derecha en eje largo de 5 cámaras. El grosor de la pared libre del ventrículo izquierdo y del septo interventricular se deben medir en imágenes bidimensionales en diástole; valores ≥6 mm son compatibles con hipertrofia.
Credit: Catheryn Partington – Joanna Dukes-McEwan
2. Tamaño de la aurícula izquierda
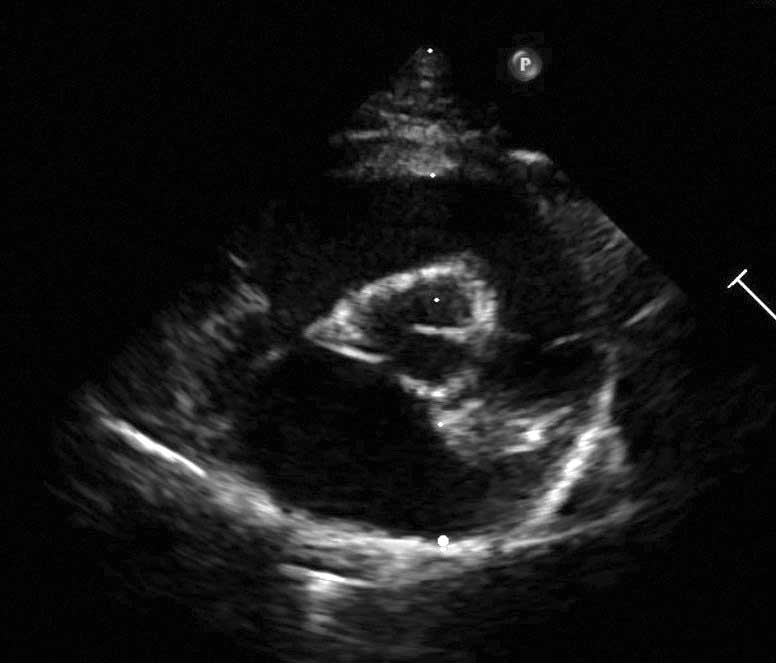
El tamaño de la aurícula izquierda es un factor de riesgo independiente de FCC, TE y muerte súbita de origen cardiaco y se puede evaluar en la vista paraesternal derecha, tanto en eje largo como en eje corto. En las vistas en eje corto a nivel de la base del corazón, las mediciones se realizan al inicio de la diástole (después del cierre de las valvas de la válvula aórtica), con el diámetro auricular indexado en relación al de la aorta (AI/Ao; Figura 4b). La aorta se mide desde el punto medio de la curvatura convexa de la pared del seno aórtico derecho hasta el punto de unión de la pared aórtica, las valvas aórticas no coronarias y la coronaria izquierda. La AI se mide desde este último punto hasta la pared libre de la AI, evitando entrar en la vena pulmonar 17.

Figura 4b. Evaluación ecocardiográfica de la cardiomiopatía hipertrófica (CMH). Vista paraesternal derecha en eje corto a nivel de la base del corazón. El tamaño de la aurícula izquierda está indexado a la raíz aórtica (LA/Ao), medido al inicio de la diástole; valores >1,6 son compatibles con dilatación de la aurícula izquierda.
Credit: Catheryn Partington – Joanna Dukes-McEwan
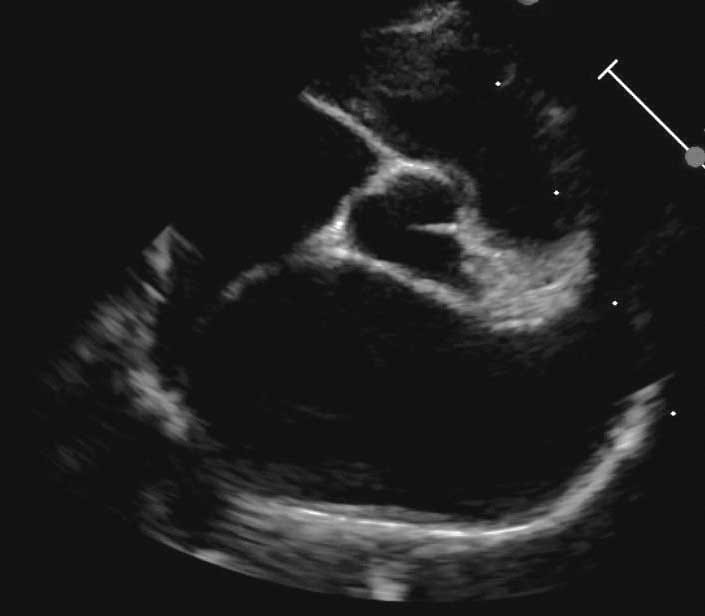
En eje largo paraesternal derecho en vista de cuatro cámaras, se debe optimizar la AI y se mide el diámetro de la aurícula izquierda (DAI) al final de la sístole (antes de la apertura de la valva de la válvula mitral), trazando una línea paralela al anillo mitral desde el septo interatrial hasta la pared libre de la AI (Figura 4c) 18. Una relación AI/Ao >1,6 y un DAI >16,0 mm son compatibles con un agrandamiento de la AI; una relación AI/Ao >1,8-2,0 o un DAI >18-19 mm se considera un agrandamiento de la AI de moderado a grave. Para valorar la función sistólica también se puede evaluar la fracción de acortamiento de la AI. La evaluación subjetiva del tamaño de la AI, la presencia de eco-contraste espontáneo o de un trombo, así como la evaluación de la velocidad dentro de la AI, también son importantes en la valoración del FCC y del riesgo de TE.

Figura 4c. Evaluación ecocardiográfica de la cardiomiopatía hipertrófica (CMH). Vista paraesternal derecha en eje largo de 4 cámaras. El diámetro de la aurícula izquierda se mide en paralelo al anillo mitral al final de la sístole; valores >16,0 mm son compatibles con dilatación de la aurícula izquierda.
Credit: Catheryn Partington – Joanna Dukes-McEwan
Abreviaturas: Ao, aorta; IVS, septo interventricular; LA, aurícula izquierda; LV, ventrículo izquierdo; LVFW pared libre del ventrículo izquierdo; MV, válvula mitral.
3. Presencia de OTSVI
La presencia de OTSVI se puede evaluar utilizando el modo bidimensional, el modo M y el Doppler color y espectral (Figura 3c). El MSA se puede visualizar tanto en modo bidimensional como en modo M. El Doppler color pondrá de manifiesto la turbulencia en el TSVI y posiblemente, la regurgitación mitral. Para evaluar la velocidad del TSVI con Doppler color es necesaria una buena alineación con el flujo; en caso de obstrucción dinámica, el perfil Doppler del flujo mostrará a menudo una aceleración bifásica (típico trazado en forma de sable).
4. Función diastólica
La función diastólica se puede evaluar tanto con Doppler espectral como con Doppler tisular, pero su discusión queda fuera del alcance de este artículo. Los gatos con CMH avanzada también pueden presentar disfunción sistólica.
La radiografía torácica es la prueba de referencia para el diagnóstico de edema pulmonar, pero en gatos asintomáticos es menos útil 14. En las radiografías se puede observar una cardiomegalia grave con abombamiento de la AI, pero su sensibilidad para detectar un remodelado leve o moderado en pacientes con CMH es menor, ya que muchos pueden presentar una silueta cardiaca normal.
Los biomarcadores se abordarán con más detalle en otro artículo, pero resumiendo, pueden ser una herramienta útil como prueba diagnóstica complementaria, así como para el seguimiento de la progresión de la enfermedad, aunque se deben utilizar con precaución como prueba de cribado. La utilidad del NT-proBNP cuantitativo (un marcador de estrés y estiramiento miocárdico) es limitada en el gato asintomático, ya que, aunque en la población general tiene una elevada especificidad como prueba de cribado, su sensibilidad es baja, lo que implica un riesgo elevado de falsos negativos. Probablemente, esta prueba sea más útil cuando se utiliza de forma selectiva en casos de sospecha de cardiomiopatía (cuando se detecta un soplo) 19 y como complemento a la ecocardiografía para investigar más sobre la gravedad de la cardiomiopatía. La prueba rápida del NT-proBNP es más útil en el gato sintomático para diferenciar entre las causas cardiacas y no cardiacas de distrés respiratorio 20.
La prueba de troponina cardiaca I (Tn I), un marcador de lesión de los cardiomiocitos, es útil junto con la ecocardiografía y se ha demostrado que los valores elevados están asociados a un peor pronóstico 21. Como consecuencia de la isquemia miocárdica se puede producir una elevación de la Tn I, lo que se observa en gatos con CMH avanzada. Una elevación importante puede levantar la sospecha de una miocarditis como causa de fenotipo secundario de CMH, lo que justifica una investigación más profunda.
Se ha demostrado que en gatos con CMH y MSA ambos biomarcadores se encuentran más elevados que en gatos con CMH sin MSA, incluso en gatos con una AI de tamaño normal/equívoco 22.
Existen pruebas genéticas para los gatos de raza Maine Coon, Ragdoll y Sphynx (Figura 5) y es recomendable realizarlas en todos los ejemplares de estas razas que se utilicen para la reproducción para reducir la prevalencia de CMH hereditaria. Se recomienda no cruzar a los individuos homocigotos para la mutación, mientras que los heterocigotos se pueden cruzar con individuos negativos para la mutación 14. Sin embargo, es importante que los criadores sepan que los gatos sin mutaciones genéticas conocidas también pueden desarrollar CMH.

Figura 5. Los veterinarios generalistas deben estar alerta y detectar signos de CMH en sus pacientes felinos, incluyendo en cualquier exploración física una auscultación cardiaca minuciosa para detectar la presencia de soplos, sonidos compatibles con ritmo de galope y arritmias, lo que justificaría una investigación adicional. Esto es especialmente importante en el caso de razas predispuestas a cardiomiopatías. Actualmente existen pruebas para detectar la mutación genética que puede causar CMH en el Sphynx.
Credit: Shutterstock
La clasificación en estadios de los gatos con CMH puede ayudar a estandarizar el tratamiento. En gatos en estadio A y estadio B1 (sin dilatación auricular izquierda o con dilatación mínima) no está indicado el tratamiento, excepto en caso de OTSVI grave, donde se puede considerar el uso de betabloqueantes (ver más adelante). Los gatos en estadio B2 tienen riesgo de TE y se recomienda la administración de clopidogrel como tratamiento preventivo. El tratamiento de los gatos en estadio C y D se discutirá en otro artículo.
Al igual que en la CMH humana, se ha demostrado que la insulina, el factor de crecimiento tipo insulina 1 y la inflamación probablemente estén implicados en la fisiopatología de la CMH felina. Por tanto, es probable que las modificaciones dietéticas, teniendo en cuenta dichos factores, sean beneficiosas. En un estudio se demostró que los gatos con CMH preclínica que recibieron una dieta restringida en almidón y suplementada con ácidos grasos omega-3 presentaron una disminución de la remodelación del VI. Si estas dietas cardiacas se comercializan en el futuro, se pueden considerar su uso para el tratamiento de los gatos en estadio B 23.
Las personas con CMH y OSTVI grave suelen presentar intolerancia al ejercicio y angina de pecho, con una mejoría de los signos clínicos tras iniciar el tratamiento con betabloqueantes. Su uso en gatos en fase preclínica con evidencia de OSTVI sigue siendo discutible y las autoras recomiendan referir al paciente a un veterinario especialista en cardiología para tomar esta decisión. En teoría, los betabloqueantes podrían ser beneficiosos en casos de una OTSVI significativa; los efectos inotrópicos y cronotrópicos negativos pueden reducir la gravedad de la obstrucción, al tiempo que mejoran el suministro de oxígeno al miocardio, reduciendo el riesgo de arritmias e isquemia. Sin embargo, no se ha demostrado ningún beneficio en cuanto a la supervivencia a largo plazo ni en la calidad de vida 24,25. Además, los betabloqueantes están contraindicados en casos de FCC y probablemente serían perjudiciales en gatos a punto de descompensarse.
Joanna Dukes-McEwan
Dada la alta prevalencia, la tendencia a presentar una fase preclínica larga y el riesgo de desarrollar signos clínicos graves, el veterinario generalista debería estar alerta e identificar a pacientes felinos con signos de CMH en estadio B. Toda exploración física debería incluir una auscultación cardiaca minuciosa para detectar soplos, sonido compatible con ritmo de galope o arritmias, cuya presencia justificaría una investigación adicional. La identificación de gatos en estadio B permite instaurar un tratamiento preventivo en caso de ser necesario, así como controlar los posibles riesgos antes de realizar procedimientos o tratamientos que podrían precipitar la descompensación del paciente. Informar adecuadamente al cuidador para detectar cualquier signo y controlar mejor al gato, también contribuye a la detección de un fallo cardiaco congestivo antes de que se desarrolle un compromiso respiratorio grave.
Payne JR, Brodbelt DC, Luis Fuentes V. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J. Vet. Cardiol. 2015;17 Suppl 1:S244-S257.
Fox PR, Keene BW, Lamb K, et al. International collaborative study to assess cardiovascular risk and evaluate long-term health in cats with preclinical hypertrophic cardiomyopathy and apparently healthy cats: the REVEAL study. J. Vet. Intern. Med. 2018;32:930-943.
Kittleson MD, Cote E. The feline cardiomyopathies: 2. Hypertrophic Cardiomyopathy. J. Feline Med. Surg. 2021;23:1028-1051.
Cote E, MacDonald KA, Meurs KM, et al. Hypertrophic Cardiomyopathy. In: Feline Cardiology. 1st ed. John Wiley & Sons, Inc. 2011 Chapter 11;101-175.
Meurs KM, Sanchez X, David RM, et al. A cardiac myosin binding protein C mutation in the Maine Coon cat with familial hypertrophic cardiomyopathy. Hum. Mol. Genet. 2005;14:3587-3593.
Meurs KM, Norgard MM, Ederer MM, et al. A substitution mutation in the myosin binding protein C gene in Ragdoll hypertrophic cardiomyopathy. Genomics 2007;90:261-264.
Meurs KM, Williams BG, de Prospero D, et al. A deleterious mutation in the ALMS1 gene in a naturally occurring model of hypertrophic cardiomyopathy in the Sphynx cat. Orphanet J. Rare Dis. 2021;16:108.
Kittleson MD, Meurs KM, Harris SP. The genetic basis of hypertrophic cardiomyopathy in cats and humans. J. Vet. Cardiol. 2015;17 Suppl 1:S53-S73.
Schober K, Todd A. Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2010;12:1e16.
Seo J, Novo Matos J, Payne JR, et al. Anterior mitral valve leaflet length in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2021;37:62-70.
Maron BJ, Maron MS. A discussion of contemporary nomenclature, diagnosis, imaging, and management of patients with hypertrophic cardiomyopathy. Am. J. Cardiol. 2016;118:1897-1907.
MacLea HB, Boon JA, Bright JM. Doppler echocardiographic evaluation of mid ventricular obstruction in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2013;27:1416-1420.
Novo Matos J, Pereira N, Glaus T, et al. Transient myocardial thickening in cats associated with heart failure. J. Vet. Intern. Med. 2018;32(1):48-56.
Luis Fuentes V, Abbott J, Chetboul V, et al. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J. Vet. Intern. Med. 2020;34:1062-1077.
Payne JR, Borgeat K, Connolly DJ, et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2013;27:1427-1436.
Haggstrom J, Andersson AO, Falk T, et al. Effect of body weight on echocardiographic measurements in 19,866 pure-bred cats with or without heart disease. J. Vet. Intern. Med. 2016;30:1601-1611.
Hansson K, Haggstrom J, Kvart C, et al. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in Cavalier King Charles Spaniels with and without left atrial enlargement. Vet. Radiol. Ultrasound 2002;43(6):569-575.
Linney CJ, Dukes-McEwan J, Stephenson HM, et al. Left atrial size, atrial function and left ventricular diastolic function in cats with hypertrophic cardiomyopathy. J. Small. Anim. Pract. 2014;55(4):198-206.
Fox PR, Rush JE, Reynolds CA, et al. Multicenter evaluation of plasma N-terminal probrain natriuretic peptide (NT-pro BNP) as a biochemical screening test for asymptomatic (occult) cardiomyopathy in cats. J. Vet. Intern. Med. 2011;25:1010-1016.
Ward JL, Lisciandro GR, Ware WA, et al. Evaluation of point-of-care thoracic ultrasound and NT-proBNP for the diagnosis of congestive heart failure in cats with respiratory distress. J. Vet. Intern. Med. 2018;32:1530-1540.
Borgeat K, Sherwood K, Payne J, et al. Plasma cardiac troponin I concentration and cardiac death in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2014;28:1731-1737.
Seo J, Payne JR, Novo Matos J, et al. Biomarker changes with systolic anterior motion of the mitral valve in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2020;34(5):1718-1727.
van Hoek I, Hodgkiss-Geere H, Bode EF, et al. Association of diet with left ventricular wall thickness, troponin I and IGF-1 in cats with subclinical hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2020;34(6):2197-2210.
Schober KE, Zientek J, Li X, et al. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J. Vet. Cardiol. 2013;15:93-104.
Coleman AE, DeFrancesco TC, Griffiths EH, et al. Atenolol in cats with subclinical hypertrophic cardiomyopathy: a double-blind, placebo-controlled, randomized clinical trial of effect on quality of life, activity, and cardiac biomarkers. J. Vet. Cardiol. 2020;30:77-91.
Catheryn Partington
La Dra. Partington se graduó por la Universidad de Liverpool en el 2014, obteniendo también el grado de máster en Ciencias Veterinarias Leer más
Joanna Dukes-McEwan
La Dra. Dukes-McEwan se licenció en 1986 por la Universidad de Glasgow continuando su formación con un internado y una residencia Leer más
Las infecciones por nematodos pulmonares y cardiacos representan una amenaza y, aunque se subestimen, son potencialmente graves para muchos gatos, tal y como revela este artículo.
La hernia diafragmática en el gato se suele producir como consecuencia de un traumatismo y puede ser fatal si no se diagnostica y trata rápidamente; en este artículo se revisa su fisiopatología y su tratamiento.
El quilotórax es parte del diagnóstico diferencial de cualquier gato con derrame pleural; en este artículo, Elizabeth Rozanski nos describe su enfoque preferido para abordar estos casos.
El asma es una enfermedad frecuente en el gato que puede parecerse a muchas otras enfermedades, lo que hace que el diagnóstico y el tratamiento puedan ser un reto para el veterinario tal y como se describe en este artículo.
