Biomarkerii cardiaci la pisici
În urma progreselor recente, au fost identificați biomarkeri care pot ajuta în diagnosticarea afecțiunilor cardiace feline. Acest articol discută utilizarea și limitările investigațiilor de acest tip.
Numărul revistei 32.2 Cardiologie
Publicat la data 07/09/2023
Disponibilă și în alte limbi Français , Deutsch , Italiano , Polski , Español și English
Cardiomiopatia hipertrofică este răspândită în rândul populației feline, dar animalele afectate pot să nu fie ușor de identificat; articolul de față oferă o prezentare generală cuprinzătoare a acestei afecțiuni, utilă pentru practica medicală veterinară generalistă.

Cardiomiopatia hipertrofică (HCM) este cea mai răspândită formă de cardiomiopatie la pisici, caracterizată prin hipertrofie ventriculară stângă și diminuarea funcției diastolice.
Detectarea unui suflu, aritmii sau ritm de galop la o pisică asimptomatică impune întotdeauna efectuarea unor investigații cardiace suplimentare.
Ecocardiografia este instrumentul de diagnostic de referință, evaluarea dimensiunii atriului stâng fiind un indicator important pentru prognostic.
HCM are o evoluție variabilă, iar faza preclinică este adesea de lungă durată; stadializarea oferă informații de prognostic și este utilă pentru a stabili necesitatea de a institui un tratament sau de a de a gestiona diferit pacientul.
Cardiomiopatia hipertrofică felină (HCM) este o boală miocardică primară definită prin hipertrofia concentrică a ventriculului stâng (VS), adică prin îngroșarea pereților VS 1. Este o boală caracterizată prin disfuncție diastolică (relaxare afectată), funcția sistolică (contractilitate) fiind în mod normal păstrată. Reducerea complianței miocardice afectează capacitatea inimii de a se relaxa și de a se umple în timpul diastolei, ceea ce crește presiunea diastolică și duce la dilatarea progresivă a atriului stâng (AS) 2. HCM este un diagnostic de excludere, fiind necesară eliminarea altor posibile boli cardiace sau sistemice care pot cauza sau contribui la un fenotip HCM, cum ar fi hipertensiunea arterială sistemică, hipertiroidismul, acromegalia și stenoza aortică. Evoluția bolii este foarte variabilă și adesea există o fază preclinică asimptomatică de lungă durată, care de obicei rămâne nedetectată. Ulterior pisicile pot prezenta semne de insuficiență cardiacă congestivă (ICC), tromboembolism arterial (TE) sau aritmii 2,3.
HCM este cea mai frecventă cardiomiopatie felină, estimându-se că afectează între 14,5-34% din populația „sănătoasă” de pisici 1,4. Cele mai multe cazuri sunt înregistrate la pisicile domestice cu păr lung și scurt 4, însă rasele pure predispuse la HCM includ pisicile din rasele Persian, British Shorthair, Maine Coon, Ragdoll, Sphynx, Himalaya și Bengal. Boala poate apărea la orice vârstă, însă pisicile de rasă pură, în special, pot prezenta forme severe la o vârstă fragedă 4. Există o suprareprezentare a masculilor, care constituie 75% dintre cazurile de CMH, în pofida faptului că nu s-a identificat niciun model ereditar legat de sex.
Catheryn Partington
HCM familială la pisicile Maine Coon, Ragdoll și Sphynx 5,6,7 este rezultatul unor mutații în proteinele sarcomerice, însă la toate celelalte pisici cauza rămâne necunoscută, deși este probabil ereditară și la alte rase pure. Sarcomerul este componenta contractilă a cardiomiocitelor, mutațiile proteinelor sarcomerice cauzând alterarea structurii și funcției sarcomerului, ceea ce duce în cele din urmă la afectarea performanțelor cardiomiocitelor. Procesul exact prin care dereglarea sarcomerului produce fenotipul CMH este complex și nu este pe deplin înțeles. Modificările sensibilității la calciu, ale funcției mecanice și ale stresului celular culminează cu hipertrofia miocitelor, sinteza colagenului și dezorganizarea miocitelor – caracteristicile histopatologice distinctive ale HCM la feline 4,8.
Două mutații diferite ale proteinei C de legare a miozinei în sarcomeri au fost identificate la rasele Maine Coon și Ragdoll (A31P, respectiv R820W) 5,6. Pacienții heterozigoți pentru aceste mutații prezintă adesea boală subclinică, cu modificări doar la nivel celular, nu și macroscopic, în timp ce pisicile homozigote sunt mai grav afectate; se suspectează un model de transmitere ereditară de dominanță incompletă. Pisicile Maine Coon care nu prezintă mutația pot dezvolta totuși un fenotip HCM, ceea ce reflectă etiologia probabil multifactorială a afecțiunii. Mai recent, o mutație în gena ALMS11 a fost identificată ca factor cauzal al HCM la pisicile Sphynx 7.
* ALMS1 = sindromul Alström 1
Așa cum s-a menționat mai sus, HCM se manifestă prin hipertrofie ventriculară stângă și disfuncție diastolică, modificările patologice reducând capacitatea ventriculului de a se relaxa și de a se umple în timpul diastolei. În plus, hipertrofia progresivă a peretelui reduce alimentarea cu sânge a cardiomiocitelor, care sunt înlocuite de țesut fibros pe măsură ce mor, ceea ce scade și mai mult complianța miocardică (rigiditate crescută). În consecință, presiunea diastolică din VS crește pentru orice volum de sânge dat, sporind astfel presiunea din AS, care apoi se mărește. Presiunea crescută a AS este transmisă înapoi în venele pulmonare, iar atunci când presiunea venoasă pulmonară depășește 25 mmHg apare edemul pulmonar, trăsătură caracteristică a ICC stângă 4. La pisici, venele care drenează pleura pulmonarăse deschid în venele pulmonare, ceea ce permite dezvoltarea revărsatului pleural în ICC stângă (spre deosebire de câini, la care revărsatul pleural este întotdeauna rezultatul ICC dreaptă, niciodată stângă) 4.
Dilatarea progresivă a AS este unul dintre factorii care predispun pisicile cu HCM severă la boli tromboembolice, însă această afecțiune nu face obiectul prezentului articol. Hipertrofia marcată, aportul redus de oxigen și fibroza de substituție din miocard favorizează dezvoltarea aritmiilor.
Hipertrofia VS în HCM felină poate implica atât septul interventricular, cât și peretele liber, sau pot apărea modificări asimetrice, care afectează local o singură regiune – de obicei baza septului interventricular. Hipertrofia poate afecta și ventriculul drept, dar modelul și distribuția pot să varieze considerabil de la un individ la altul (Figurile 1 și 2) 4. Pot exista de asemenea modificări ale aparatului valvei mitrale, inclusiv alungirea foiței valvulare mitrale anterioare și hipertrofia mușchilor papilari. Mișcarea sistolică anterioară (MSA) a valvei mitrale este o caracteristică frecventă a HCM și poate cauza obstrucția semnificativă a tractului de ejecție al ventriculului stâng (LVOTO) 9,10.


Figura 1. Modelul hipertrofiei VS în cardiomiopatia hipertrofică felină poate să varieze foarte mult de la un individ la altul, însă hipertrofia ventriculară stângă difuză se poate observa macroscopic la aceste probe anatomo-patologice.
Abrevieri: LVFW, peretele liber al ventriculului stâng; IVS, sept interventricular (SIV); RV, ventricul drept (VD)
Prin amabilitatea lui Emanuele Ricci, Universitatea din Liverpool, Marea Britanie.

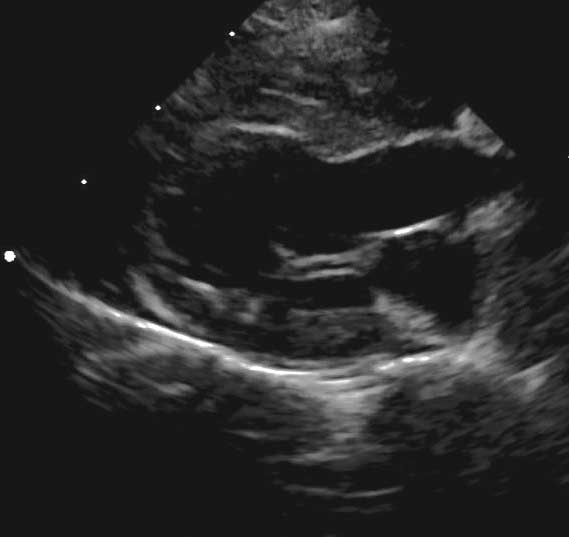
Figura 2a. Observațiile ecocardiografice ale HCM pot să prezinte o mare variabilitate. Vizualizare parasternală dreaptă în ax lung cu 5 camere prezentând o regiune focală de hipertrofie care afectează septul bazal (*).
Credit: Catheryn Partington – Joanna Dukes-McEwan

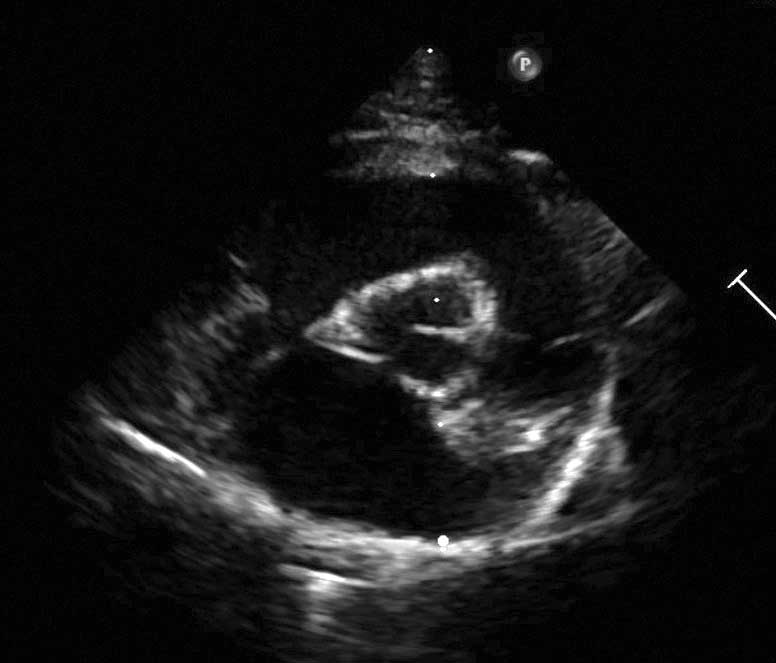
Figura 2b. Observațiile ecocardiografice ale HCM pot să prezinte o mare variabilitate. Vizualizare parasternală dreaptă în ax scurt la nivelul mușchilor papilari prezentând hipertrofia ventriculară stângă și a mușchilor papilari.
Credit: Catheryn Partington – Joanna Dukes-McEwan

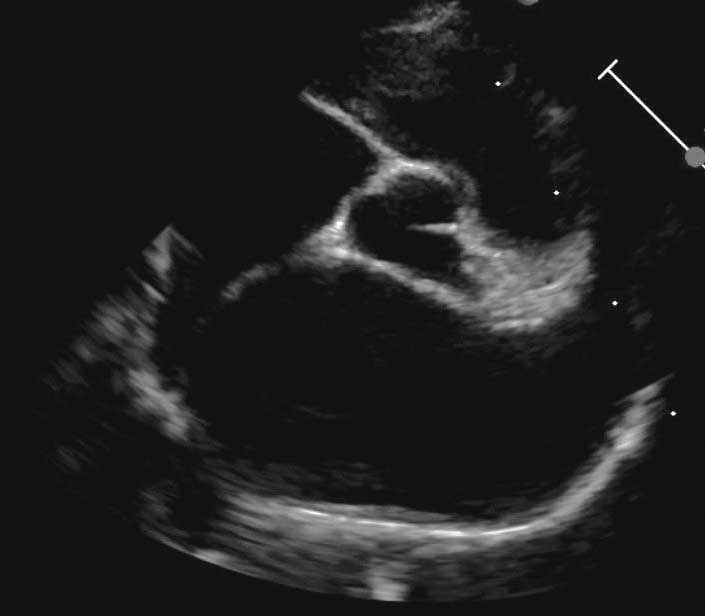
Figura 2c. Observațiile ecocardiografice ale HCM pot să prezinte o mare variabilitate. Vizualizare parasternală dreaptă în ax lung cu 4 camere prezentând hipertrofia simetrică a septului interventricular și a peretelui liber al ventriculului stâng.
Credit: Catheryn Partington – Joanna Dukes-McEwan
Abrevieri: LA , atriul stâng (AS); LV, ventriculul stâng (VS); Pm, mușchiul papilar
O subcategorie de pisici cu HCM poate să prezinte o obstrucție semnificativă a tractului de ejecție a ventriculului stâng (LVOTO) (Figura 3). În mod tradițional, astfel de cazuri au fost denumite cardiomiopatie hipertrofică obstructivă, însă în medicina umană acest termen a fost abandonat, deoarece prezența LVOTO poate fi intermitentă și, dat fiind că acest lucru este valabil și în cazul pisicilor, termenul este probabil perimat ,3,9,11. LVOTO poate fi rezultatul mișcării sistolice anterioare (MSA) a valvei mitrale, al hipertrofiei focalizate a septului bazal sau, mai rar, al obstrucției cavității medii din cauza hipertrofiei mușchilor papilari 4,9,12. Acest tip de LVOTO determină un suflu ca urmare a turbulenței sanguine crescute. În cazul MSA, obstrucția este de obicei dinamică, agravându-se odată cu creșterea contractilității cardiace, de exemplu în timpul stresului fizic sau emoțional. Acesta este adesea motivul pentru care prezența sau intensitatea suflurilor variază la pisicile cu HCM.
MSA a valvei mitrale apare atunci când foița septală (anterioară) (adesea alungită) este trasă spre tractul de ejecție în urma hipertrofiei și deplasării mușchiului papilar, ceea ce cauzează slăbirea cordajelor tendinoase 10. Pe măsură ce tractul de ejecție se îngustează ca urmare a acestei mișcări anormale a foiței (sau din cauza hipertrofiei septului bazal), viteza sanguină crește și presiunea scade, trăgând vârful foiței și mai mult în tractul de ejecție și agravând obstrucția (efectul Venturi) 4,9. Se consideră că MSA crește necesarul de oxigen al miocardului și reduce perfuzia coronariană, crescând riscul de ischemie miocardică; există probabil o asociere cu hipertrofia progresivă și disfuncția microvasculară. Se presupune că unele pisici cu LVOTO severă prezintă semne de reducere a capacității de efort și dureri anginoase, așa cum se întâmplă și la oameni.

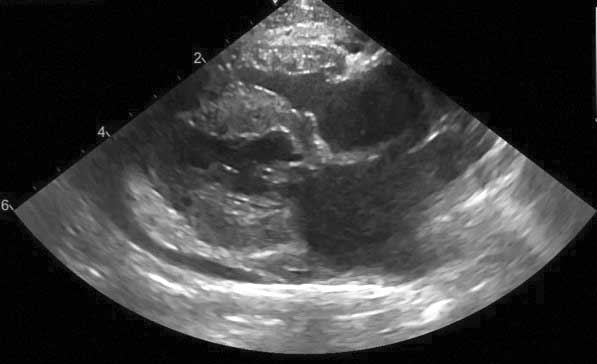
Figura 3a. La pisicile cu CMH suflurile sunt cel mai adesea rezultatul obstrucției tractului de ejecție al ventriculului stâng (LVOTO). Vizualizare parasternală dreaptă în ax lung cu 5 camere în Doppler color prezentând un jet sanguin turbulent în tractul de ejecție al ventriculului stâng (săgeată deschisă) cauzat de mișcarea sistolică anterioară a valvei mitrale și un mic jet excentric de regurgitare mitrală (săgeată mică).
Credit: Catheryn Partington – Joanna Dukes-McEwan

Figura 3b. . La pisicile cu CMH suflurile sunt cel mai adesea rezultatul obstrucției tractului de ejecție al ventriculului stâng (LVOTO). Vizualizare parasternală dreaptă în ax lung cu 5 camere care arată hipertrofia localizată la nivelul septului bazal (*) ca fiind cauza LVOTO.
Credit: Catheryn Partington – Joanna Dukes-McEwan

Figura 3c. La pisicile cu CMH suflurile sunt cel mai adesea rezultatul obstrucției tractului de ejecție al ventriculului stâng (LVOTO). Doppler spectral al LVOT arătând viteze crescute (*) și accelerație bifazică (forma clasică de „scimitar”), care indică LVOTO.
Prin amabilitatea lui J. Novo Matos, Universitatea din Cambridge, Marea Britanie.
Abrevieri: Ao, aorta; LA, atriul stâng (AS); LV, ventriculul stâng (VS)
Îngroșarea tranzitorie a miocardului este un diagnostic diferențial important pentru un fenotip HCM. Este rară și insuficient înțeleasă, dar se caracterizează prin creșterea grosimii peretelui VS și dilatarea AS, mai puțin evidentă decât cea observată în HCM primară, cu remiterea completă a semnelor clinice și a modificărilor ecocardiografice în decurs de câteva luni. Prin urmare, îngroșarea tranzitorie a miocardului are un prognostic excelent. Pisicile care prezintă ICC secundară îngroșării tranzitorii a miocardului sunt în general mai tinere decât cele cu HCM primară, fiind adesea raportat un eveniment antecedent (de exemplu anestezie generală). S-a propus ipoteza că îngroșarea peretelui este cauzată de edemul miocardic, prezentând similitudini atât cu miocardita acută, cât și cu cardiomiopatia indusă de stres la om 13.
Recomandările formulate recent de ACVIM privind diagnosticul și tratamentul HCM 14 prezintă un sistem de stadializare similar celui utilizat pentru degenerarea mixomatoasă a valvei mitrale la câini (Caseta 1). Acest sistem poate fi util pentru a stabili dacă este indicat un tratament, precum și pentru a oferi proprietarilor o oarecare idee despre ceea ce urmează, dat fiind că evoluția HCM și implicit prognosticul acesteia variază considerabil. La unele pisici, boala este progresivă, ducând la ICC, TE și deces cardiac, în timp ce altele ar putea să rămână în stadiul preclinic și să moară în cele din urmă din cauze non-cardiace 14,15. Motivul acestei eterogenități rămâne neclar și este dificil de prezis care sunt pisicile care ar putea muri din cauza bolii, deși mai multe studii retrospective au identificat o serie de factori de prognostic. Pisicile diagnosticate la o vârstă mai tânără tind să aibă durate de supraviețuire mai lungi 2. Pisicile care dezvoltă ICC secundară unor factori precum stresul sau fluidoterapia intravenoasă (IVFT) au de obicei o supraviețuire mai îndelungată decât alte pisici cu HCM în stadiul C. Ritmul de galop, aritmiile, dilatația severă a AS, reducerea funcției sistolice a AS, contrastul ecografic spontan, hipertrofie parietală severă (> 9 mm), disfuncția sistolică a LV și subțierea focală a peretelui sunt asociate cu un risc crescut de ICC și / sau TE 2,15.
Caseta 1. Stadializarea HCM la feline conform ACVIM.
 |
Stadiul A |
Stadiul A: pisici predispuse la HCM, dar care nu prezintă semne de HCM; de exemplu, o pisică Maine Coon cu mutația genetică A31P sau o pisică având o rudă apropiată diagnosticată cu HCM. La examinarea ecografică inima va prezenta structură fiziologică. |
 |
Stadiul B1 |
Stadiul B: Pisici cu HCM preclinic (adică fără simptome clinice, dar cu indicii ecocardiografice de HCM). Acest stadiu este apoi subdivizat în funcție de severitatea bolii și de riscul de ICC și TE.
• Stadiul B1: risc scăzut de a dezvolta ICC sau TE, cu AS normal sau ușor dilatat.
• Stadiul B2: risc mai ridicat de apariție iminentă a ICC sau TE, cu dilatare moderată sau severă a AS.
|
 |
Stadiul B2 | |
 |
Stadiul C | Stadiul C: pisici cu simptome clinice de HCM și ICC sau TE. |
 |
Stadiul D |
Stadiul D: Pisici cu CMH și cu ICC refractară la tratament.
|
Credit: Catheryn Partington
Dată fiind reducerea funcției diastolice și, ca urmare a acesteia, creșterea presiunilor pentru orice volum de sânge din VS, pisicile cu HCM sunt mai sensibile la creșterile volumului circulant (adică presarcină crescută). Anumite tratamente, cum ar fi utilizarea prelungită a corticosteroizilor și fluidoterapia intravenoasă ar putea deci să determine progresia bolii pisicii cu HCM avansată la ICC stângă. Acest lucru evidențiază importanța identificării pisicilor cu boală preclinică, astfel încât tratamentele asociate să poată fi modificate și monitorizate îndeaproape (de exemplu, reducerea ratelor de perfuzare în IVFT, monitorizare mai atentă a frecvenței respiratorii și evaluarea imagistică periodică a dimensiunii atriului stâng) pentru a reduce riscul de decompensare. În plus, pisicile cu HCM avansată prezintă risc de tromboembolism, iar identificarea acestora permite inițierea unei terapii anticoagulante preventive.
Identificarea pisicilor aflate în stadiul B poate facilita depistarea semnelor subtile de progresie timpurie către stadiul C, deoarece proprietarii ar fi mai bine informați și mai atenți la eventualele simptome de ICC, permițând astfel inițierea tratamentului înainte ca pacientul să dezvolte un edem pulmonar fulminant și insuficiență respiratorie severă.
Provocarea principală pe care o presupune HCM este durata variabilă a fazei preclinice și lipsa frecventă a oricăror semne clinice sau anomalii decelabile la examinarea fizică. Modificările constatate la examenul clinic care ar putea ridica suspiciunea de HCM în stadiul B includ prezența unui suflu (Caseta 2), a ritmului de galop (Caseta 3) sau a unei aritmii 4. Deși multe pisici cu HCM asimptomatică vor prezenta un suflu, peste 31-62% dintre acestea nu vor avea suflu; mai mult, 25-33% dintre pisicile cu suflu sistolic parasternal stâng (de obicei slab, de intensitate scăzută) nu prezintă nicio dovadă ecocardiografică de cardiomiopatie 1,4. În cazul suflurilor de intensitate mai mare (> grad 3/6) există o probabilitate mai ridicată de a fi asociate cu o boală cardiacă semnificativă 4, însă orice suflu necesită investigații suplimentare.
Caseta 2. Cauzele suflurilor în HCM preclinică.
|
Suflurile se aud atunci când fluxul sanguin devine turbulent; acest lucru poate fi consecința vitezei mari a fluxului sanguin, a diametrului mare al vaselor, a densității ridicate a fluidului sau a vâscozității scăzuteÎn cazul HCM, suflurile sunt cel mai adesea rezultatul obstrucției tractului de ejecție al ventriculului stâng (LVOT) din cauza mișcării anterioare sistolice a valvei mitrale și / sau a hipertrofiei focale a septului bazal.
La pisicile cu HCM, suflurile sunt adesea dinamice, ceea ce înseamnă că își pot schimba intensitatea și pot chiar să fie absente. Gradul de obstrucție este probabil mai grav atunci când inima se contractă cu mai multă forță (adică atunci când catecolaminele cresc din cauza stresului), cauzând un suflu de intensitate mai mare.
|
Caseta 3. Ce sunt zgomotele de galop?
|
La majoritatea pisicilor și câinilor sănătoși, doar primul (S1) și al doilea (S2) zgomot cardiac sunt detectate la auscultare. Ritmul de galop este un zgomot cardiac suplimentar ce poate fi auzit, și care creează o cadență în trei timpi similară sunetului produs de un cal care galopează.
Cauza este fie un al treilea (S3), fie un al patrulea (S4) zgomot cardiac ce poate fi ascultat, deși acestea sunt adesea dificil de diferențiat la auscultare. S3 este rezultatul umplerii ventriculare rapide la începutul diastolei, în timp ce S4 este rezultatul umplerii ventriculare active prin contracție atrială la finalul diastolei.
Detectarea ritmului de galop la auscultare indică în general disfuncție diastolică, și 2,6-19% dintre pisicile cu CMH subclinică prezintă ritm de galop 19. Aceste zgomote sunt rareori detectate prin auscultare la pisicile sănătoase, prin urmare prezența lor ar trebui să impună întotdeauna efectuarea unor investigații cardiace suplimentare.
|
Credit: Catheryn Partington – Joanna Dukes-McEwan
Ecocardiografia constituie standardul de referință pentru diagnosticarea HCM 14, și, dacă se identifică hipertrofie, trebuie investigate cauzele hipertrofiei secundare (a se vedea partea a doua). Ecocardiografia ar trebui recomandată oricărei pisici cu semne clinice care ar putea fi atribuite unei cardiomiopatii (sincopă, intoleranță la efort, intoleranță la IVFT), celor cu antecedente familiale de HCM (sau moarte subită), pisicilor de rasă pură destinate reproducerii și pisicilor la care rezultatele la examenul fizic sugerează o cardiomiopatie (ritm de galop, aritmii, murmur, tahipnee, dispnee, sunete pulmonare reduse). Declarația de consens ACVIM recomandă de asemenea efectuarea unei evaluări ecocardiografice la pisicile cu vârsta de peste 9 ani supuse unor intervenții care pot favoriza ICC (de exemplu, anestezie generală, IVFT și terapie prelungită cu corticosteroizi) 14.
La pisicile asimptomatice, ecocardiografia permite evaluarea a patru criterii principale: grosimea peretelui VS, dimensiunea AG, prezența LVOTO și funcția diastolică. În cazurile de boală moderată sau severă, primele două criterii sunt relativ ușor de evaluat de către un medic veterinar generalist cu competențe ecografice de bază.
1. Grosimea peretelui ventricular stâng
Atât septul interventricular, cât și peretele liber al VS trebuie evaluate, cu măsurători efectuate prin ecocardiografie 2D, în vizualizări parasternale drepte la finalul diastolei (cadrul anterior închiderii foițelor valvei mitrale) (Figura 4a). Deoarece hipertrofia poate fi focală, măsurătorile ar trebui efectuate pe parcursul a cel puțin trei cicluri cardiace și, în mod ideal, în mai multe locații. La măsurarea peretelui, trebuie avut grijă să nu se includă mușchii papilari sau regiuni cu îngroșare endocardică pronunțată. O grosime a peretelui VS la finalul diastolei mai mică de 5 mm este normală, iar valorile ≥ 6 mm sugerează hipertrofie 14. Valorile de 5-6 mm rămân într-o zonă gri și trebuie interpretate în funcție de talie, rasă și alte variabile ecocardiografice 16.

Figura 4a. Evaluare ecocardiografică a cardiomiopatiei hipertrofice (HCM). Vizualizare parasternală dreaptă în ax lung cu 5 camere. Grosimea peretelui liber al ventriculului stâng și a septului interventricular trebuie măsurată pe imagini 2D în diastolă; valorile ≥ 6 mm indică hipertrofie.
Credit: Catheryn Partington – Joanna Dukes-McEwan
2. Dimensiunea atriului stâng
Dimensiunea AS este un factor de risc independent pentru ICC, TE și decesul cardiac și poate fi evaluat atât pe vizualizările parasternale drepte în ax lung, cât și în ax scurt. În vizualizările în ax scurt la baza inimii, măsurătorile se efectuează la debutul diastolei (cadrul de după închiderea cuspelor valvulare aortice), diametrul atrial fiind corelat cu aorta (LA/Ao în Figura 4b). Aorta se măsoară de la mijlocul curburii convexe a peretelui sinusului aortic drept până la punctul în care converg peretele aortic, cuspele aortice non-coronare și coronare stângi. AS se măsoară din acest ultim punct până la peretele liber al AS, evitând pătrunderea în vena pulmonară. 17.

Figura 4b. Evaluare ecocardiografică a cardiomiopatiei hipertrofice (HCM). Vizualizare parasternală dreaptă în ax scurt la baza inimii. Dimensiunea atriului stâng este corelată cu rădăcina aortică (AS/Ao), măsurată la debutul diastolei; valorile > 1,6 indică dilatarea atriului stâng.
Credit: Catheryn Partington – Joanna Dukes-McEwan
În vizualizare parasternală dreaptă în ax lung cu patru camere, AS trebuie optimizat, iar diametrul atriului stâng (DAS) trebuie măsurat la finalul sistolei (cadrul anterior deschiderii foiței valvei mitrale), trasând o linie paralelă cu inelul mitral de la septul interatrial până la peretele liber al AS (Figura 4c) 18. Un raport AS/Ao > 1,6 și DAS > 16,0 mm indică mărirea AS; valorile AS/Ao >1,8-2,0 sau DAS > 18-19 mm indică o mărire moderată până la severă a AS. Scurtarea fracționată a AS poate fi de asemenea determinată pentru a evalua funcția sistolică. Evaluarea subiectivă a dimensiunii apendicelui auricular stâng, prezența unui contrast ecocardiografic spontan sau a unui tromb și evaluarea vitezelor apendicelui auricular stâng sunt de asemenea factori importanți pentru analiza riscului de ICC și TE.

Figura 4c. Evaluare ecocardiografică a cardiomiopatiei hipertrofice (HCM). Vizualizare parasternală dreaptă în ax lung cu 4 camere. Diametrul atriului stâng este măsurat paralel cu inelul mitral la finalul sistolei; valorile > 16,0 mm indică dilatarea atriului stâng.
Credit: Catheryn Partington – Joanna Dukes-McEwan
Abrevieri: Ao, aorta; IVS (SIV), sept interventricular; LA, atriul stâng (AS); LV, ventriculul stâng (VS); LVFW, peretele liber al ventriculului stâng; MV, valva mitrală (VM).
3. Prezența obstrucției LVOT
Aceasta poate fi evaluată în Doppler 2D, mod M, cu flux color și spectral (Figura 3c). MSA se poate vizualiza atât în modul 2D, cât și în modul M. Modul Doppler cu flux color va evidenția turbulența în LVOT, posibil și regurgitarea mitrală. Modul Doppler spectral necesită o bună aliniere de flux pentru a evalua vitezele LVOT; în cazul unei obstrucții dinamice, profilul Doppler va arăta adesea o accelerație bifazică (formă clasică de scimitar).
4. Funcția diastolică
Funcția diastolică poate fi evaluată imagistic atât prin Doppler spectral, cât și prin Doppler tisular, însă o discuție aprofundată depășește sfera acestui articol. Pisicile cu HCM avansată pot prezenta de asemenea afectarea funcției sistolice.
Radiografia toracică este standardul de referință pentru diagnosticarea edemului pulmonar, dar are o utilitate redusă în cazul pisicilor asimptomatice 14. Se poate observa cardiomegalia severă cu AS proeminent, însă radiografiile au o sensibilitate mai scăzută pentru detectarea remodelării ușoare sau moderate la pacienții cu HCM, care de multe ori pot prezenta o siluetă cardiacă fiziologică.
Biomarkerii vor fi discutați mai detaliat în alt articol, dar, pe scurt, aceștia pot fi un instrument util în asociere cu alte metode diagnostice și pentru monitorizarea progresiei bolii, deși ar trebui folosiți cu precauție ca instrument de screening. La pisicile asimptomatice, determinarea cantitativă a NT-proBNP (un marker al stresului și al întinderii miocardice) are o utilizare limitată ca instrument de screening în populația generală, deoarece, deși are o specificitate ridicată, sensibilitatea este scăzută, ceea ce înseamnă un risc ridicat de rezultate fals negative. Testul este probabil mai adecvat atunci când este utilizat selectiv în cazurile în care există suspiciune de cardiomiopatie (adică atunci când se detectează un suflu) 19 și în asociere cu ecocardiografia pentru a evalua mai bine gravitatea cardiomiopatiei. Testul NT-proBNP care poate fi efectuat în cabinet (tip POCT) este mai util în cazul pisicilor simptomatice pentru a face distincția între cauzele cardiace și non-cardiace ale dispneei 20.
Troponina cardiacă I (Tn I), un marker al afectării cardiomiocitelor, prezintă de asemenea utilitate în asociere cu ecocardiografia și s-a demonstrat că are semnificație prognostică, valorile crescute fiind asociate cu o evoluție mai nefavorabilă 21. Ischemia miocardică poate determina niveluri ridicate, fapt ce a fost constatat în HCM felină avansată. Creșterile severe pot ridica suspiciunea de miocardită care cauzează un fenotip secundar de HCM, ceea ce impune investigații suplimentare.
S-a demonstrat că ambii biomarkeri au niveluri mai ridicate la pisicile cu HCM și MSA, comparativ cu cazurile de HCM fără MSA, chiar și la pisicile cu o dimensiune normală / neconcludentă a AS 22.
Testarea genetică este disponibilă pentru pisicile Maine Coon, Ragdoll și Sphynx (Figura 5) și este recomandată tuturor pisicilor de reproducție care aparțin acestor rase pentru a reduce prevalența ereditară a CM. Reproducția indivizilor homozigoți pentru mutație nu este indicată, iar pisicile heterozigote pot fi împerecheate cu indivizi cu rezultat negativ pentru mutație 14. Cu toate acestea, crescătorii trebuie să fie conștienți de faptul că și pisicile care nu prezintă mutațiile genetice cunoscute pot să dezvolte HCM.

Figura 5. Medicii din clinicile veterinare trebuie să fie vigilenți în privința simptomelor de HCM la pacienții lor și toate examinările pacienților felini trebuie să includă o auscultare cardiacă atentă pentru a detecta eventuala prezență a suflurilor, a ritmului de galop și a aritmiilor, deoarece oricare dintre acestea impune investigații suplimentare. Acest lucru este valabil mai ales în cazul raselor predispuse la cardiomiopatii, în prezent fiind disponibile teste pentru detectarea mutației genetice care ar putea fi responsabilă pentru HCM la pisicile Sphynx.
Credit: Shutterstock
Stadializarea pisicilor cu HCM poate ajuta la standardizarea tratamentului. Pentru pisicile aflate în stadiul A și B1 (fără dilatare / dilatare minimă a atriului stâng) nu este indicat niciun tratament cu excepția cazurilor de LVOTO severă, situații în care pot fi luate în considerare beta-blocantele (a se vedea mai jos). Pisicile în stadiul B2 prezintă risc de TE, fiind recomandată terapia preventivă cu clopidogrel. Tratamentul pisicilor în stadiul C și D va fi discutat în partea 2.
La fel ca în cazul HCM umane, s-a demonstrat că insulina, factorul de creștere asemănător insulinei-1 și inflamația sunt probabil implicate în fiziopatologia HCM la feline. Prin urmare, modificările nutriționale care vizează acești factori ar putea avea efecte benefice; un studiu a demonstrat reducerea remodelării VS la pisicile cu HCM preclinic hrănite cu o dietă cu conținut scăzut de amidon și suplimentată cu acizi grași omega-3. Dacă astfel de diete cardiace pentru feline vor fi disponibile în comerț în viitor, această opțiune ar putea fi considerată ca intervenție terapeutică la pisicile în stadiul B 23.
La oameni, se raportează frecvent intoleranță la efort și angină pectorală în cazul pacienților cu HCM și LVOTO severă, cu ameliorarea simptomelor clinice în urma tratamentului cu beta-blocante. Utilizarea acestora la pisicile aflate în stadiul preclinic cu dovezi de LVOTO rămâne discutabilă, iar autorii recomandă ca aceste cazuri să fie trimise la un cardiolog pentru a putea evalua această decizie. Teoretic, beta-blocantele par favorabile în cazurile de LVOTO marcată; efectele inotrope și cronotrope negative ar putea reduce severitatea obstrucției, îmbunătățind în același timp aportul de oxigen miocardic și reducând riscul de aritmii și ischemie. Cu toate acestea, nu s-a demonstrat niciun beneficiu pentru supraviețuirea pe termen lung sau pentru calitatea vieții 24,25. În plus, beta-blocantele sunt contraindicate în cazurile de ICC și ar fi probabil nocive pentru pisicile aflate în pragul decompensării.
Joanna Dukes-McEwan
Având în vedere că HCM are o prevalență ridicată la pisici, cu tendința de a avea o fază preclinică îndelungată și risc de simptome clinice grave, medicul veterinar trebuie să fie vigilent la semnele de boală în stadiul B la pacienții săi felini. Toate examinările ar trebui să includă o auscultare atentă pentru a detecta prezența suflurilor, a ritmului de galop și a aritmiilor, oricare dintre acestea impunând investigații suplimentare. Identificarea pisicilor în stadiul B permite inițierea unei terapii preventive, dacă este cazul, precum și gestionarea riscurilor înaintea efectuării unor intervenții sau tratamente care ar putea precipita decompensarea. O mai bună informare și vigilență a proprietarilor poate facilita de asemenea detectarea insuficienței cardiace congestive înainte de apariția detresei respiratorii severe.
Payne JR, Brodbelt DC, Luis Fuentes V. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J. Vet. Cardiol. 2015;17 Suppl 1:S244-S257.
Fox PR, Keene BW, Lamb K, et al. International collaborative study to assess cardiovascular risk and evaluate long-term health in cats with preclinical hypertrophic cardiomyopathy and apparently healthy cats: the REVEAL study. J. Vet. Intern. Med. 2018;32:930-943.
Kittleson MD, Cote E. The feline cardiomyopathies: 2. Hypertrophic Cardiomyopathy. J. Feline Med. Surg. 2021;23:1028-1051.
Cote E, MacDonald KA, Meurs KM, et al. Hypertrophic Cardiomyopathy. In: Feline Cardiology. 1st ed. John Wiley & Sons, Inc. 2011 Chapter 11;101-175.
Meurs KM, Sanchez X, David RM, et al. A cardiac myosin binding protein C mutation in the Maine Coon cat with familial hypertrophic cardiomyopathy. Hum. Mol. Genet. 2005;14:3587-3593.
Meurs KM, Norgard MM, Ederer MM, et al. A substitution mutation in the myosin binding protein C gene in Ragdoll hypertrophic cardiomyopathy. Genomics 2007;90:261-264.
Meurs KM, Williams BG, de Prospero D, et al. A deleterious mutation in the ALMS1 gene in a naturally occurring model of hypertrophic cardiomyopathy in the Sphynx cat. Orphanet J. Rare Dis. 2021;16:108.
Kittleson MD, Meurs KM, Harris SP. The genetic basis of hypertrophic cardiomyopathy in cats and humans. J. Vet. Cardiol. 2015;17 Suppl 1:S53-S73.
Schober K, Todd A. Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2010;12:1e16.
Seo J, Novo Matos J, Payne JR, et al. Anterior mitral valve leaflet length in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2021;37:62-70.
Maron BJ, Maron MS. A discussion of contemporary nomenclature, diagnosis, imaging, and management of patients with hypertrophic cardiomyopathy. Am. J. Cardiol. 2016;118:1897-1907.
MacLea HB, Boon JA, Bright JM. Doppler echocardiographic evaluation of mid ventricular obstruction in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2013;27:1416-1420.
Novo Matos J, Pereira N, Glaus T, et al. Transient myocardial thickening in cats associated with heart failure. J. Vet. Intern. Med. 2018;32(1):48-56.
Luis Fuentes V, Abbott J, Chetboul V, et al. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J. Vet. Intern. Med. 2020;34:1062-1077.
Payne JR, Borgeat K, Connolly DJ, et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2013;27:1427-1436.
Haggstrom J, Andersson AO, Falk T, et al. Effect of body weight on echocardiographic measurements in 19,866 pure-bred cats with or without heart disease. J. Vet. Intern. Med. 2016;30:1601-1611.
Hansson K, Haggstrom J, Kvart C, et al. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in Cavalier King Charles Spaniels with and without left atrial enlargement. Vet. Radiol. Ultrasound 2002;43(6):569-575.
Linney CJ, Dukes-McEwan J, Stephenson HM, et al. Left atrial size, atrial function and left ventricular diastolic function in cats with hypertrophic cardiomyopathy. J. Small. Anim. Pract. 2014;55(4):198-206.
Fox PR, Rush JE, Reynolds CA, et al. Multicenter evaluation of plasma N-terminal probrain natriuretic peptide (NT-pro BNP) as a biochemical screening test for asymptomatic (occult) cardiomyopathy in cats. J. Vet. Intern. Med. 2011;25:1010-1016.
Ward JL, Lisciandro GR, Ware WA, et al. Evaluation of point-of-care thoracic ultrasound and NT-proBNP for the diagnosis of congestive heart failure in cats with respiratory distress. J. Vet. Intern. Med. 2018;32:1530-1540.
Borgeat K, Sherwood K, Payne J, et al. Plasma cardiac troponin I concentration and cardiac death in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2014;28:1731-1737.
Seo J, Payne JR, Novo Matos J, et al. Biomarker changes with systolic anterior motion of the mitral valve in cats with hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2020;34(5):1718-1727.
van Hoek I, Hodgkiss-Geere H, Bode EF, et al. Association of diet with left ventricular wall thickness, troponin I and IGF-1 in cats with subclinical hypertrophic cardiomyopathy. J. Vet. Intern. Med. 2020;34(6):2197-2210.
Schober KE, Zientek J, Li X, et al. Effect of treatment with atenolol on 5-year survival in cats with preclinical (asymptomatic) hypertrophic cardiomyopathy. J. Vet. Cardiol. 2013;15:93-104.
Coleman AE, DeFrancesco TC, Griffiths EH, et al. Atenolol in cats with subclinical hypertrophic cardiomyopathy: a double-blind, placebo-controlled, randomized clinical trial of effect on quality of life, activity, and cardiac biomarkers. J. Vet. Cardiol. 2020;30:77-91.
Catheryn Partington
Dr. Partington a absolvit Universitatea din Liverpool în anul 2014 și, după ce a obținut și titlul de Master în științe veterinare, a revenit la aceeași universitate pentru a efectua un stagiu multidisciplinar și un rezidențiat în cardiologie pe care l-a finalizat în 2021. Citiți mai mult
Joanna Dukes-McEwan
Prof. Dukes-McEwan deține diploma ECVIM și lucrează din 2004 la Universitatea din Liverpool, unde predă cardiologie în cadrul programului de licență și este implicată în cercetarea clinică, fiind autor sau coautor a peste 80 de lucrări publicate. Citiți mai mult
În urma progreselor recente, au fost identificați biomarkeri care pot ajuta în diagnosticarea afecțiunilor cardiace feline. Acest articol discută utilizarea și limitările investigațiilor de acest tip.
Hipertensiunea arterială la pisici este acum recunoscută ca o contribuție semnificativă la îmbonavirea pisicilor; Dr. Alice Rădulescu vă oferă o privire de ansamblu asupra cauzelor subiacente ale acesteia și a mijloacelor de diagnosticare.
