Les nématodes pulmonaires et cardiaques du chat
Cet article montre que les nématodes pulmonaires et cardiaques sont sous-estimés alors que ces parasites représentent une grave menace pour de nombreux chats.
Numéro du magazine 32.2 Autre scientifique
Publié 08/12/2022
Aussi disponible en Deutsch , Italiano , Español et English
La hernie diaphragmatique est une conséquence fréquente des traumatismes chez les chats. Elle peut être fatale si elle n’est pas rapidement diagnostiquée et traitée. Cet article passe en revue la physiopathologie et le traitement de cette affection.

Une hernie diaphragmatique traumatique (HDT) doit être envisagée chez tout chat suspecté d’avoir subi un traumatisme majeur.
Une HDT peut exister en l’absence d’atteinte respiratoire, en particulier dans les cas les plus chroniques.
Le diagnostic de HDT sera généralement établi par radiographie thoracique.
Stabiliser l’état des chats avant la chirurgie est primordial, mais le pronostic est généralement bon : des études récentes donnent des taux de mortalité inférieurs à 15 %.
Chez le chat, les hernies diaphragmatiques traumatiques (HDT) résultent le plus souvent d’un traumatisme et, lorsque la cause en est connue, environ 90 % des cas sont liés à un accident sur la voie publique 1,2,3. Les chats peuvent présenter un déficit respiratoire potentiellement mortel. Pour maximiser leurs chances de survie, un diagnostic rapide et une stabilisation initiale, suivis d’un traitement chirurgical approprié, sont cruciaux. Le pronostic sera alors bon dans la majorité des cas.
Le diaphragme est situé à l’entrée caudale du thorax et sépare le thorax de l’abdomen. Environ 20 % du diaphragme est constitué d’un tendon central en forme de Y, le reste étant constitué de trois régions musculaires : la pars lumbalis dorsalement, la pars sternalis ventralement et la pars costalis bilatéralement. La pars lumbalis part du bord crânio-ventral de L4 et du corps de L3, formant les piliers droit et gauche. Le pilier droit est sensiblement plus épais que le gauche. La pars costalis s’insère obliquement à travers les côtes 8 à 13, et la pars sternalis s’insère sur le processus xiphoïde. Le diaphragme est innervé par les deux nerfs phréniques, l’apport sanguin étant assuré par les artères phréniques principales et les veines phréniques supérieures. Le diaphragme est percé dorsalement par le hiatus aortique, permettant le passage de l’aorte, du canal thoracique et des veines azygos et hémi-azygos, entre le thorax et l’abdomen. Au milieu du diaphragme, entre les muscles lombaires associés, l’œsophage et les nerfs vagues gauche et droit passent par le hiatus œsophagien, tandis que la veine cave caudale et le nerf phrénique droit pénètrent dans l’abdomen par le foramen quadrilatère ou hiatus tendineux 4.
Pendant l’inspiration, la contraction du diaphragme et des muscles intercostaux externes augmente le volume de la cavité thoracique en repoussant l’abdomen caudalement et en étirant les côtes asternales. Cela réduit la pression intrathoracique, permet l’expansion des poumons et l’arrivée d’air à l’intérieur. Pendant l’expiration, la relaxation des muscles intercostaux et du diaphragme augmente la pression intrathoracique, et l’air sort des poumons. La modification de la pression intra-abdominale induite par la contraction du diaphragme joue également un rôle lors de la miction, de la défécation et des vomissements.
Les hernies diaphragmatiques traumatiques peuvent résulter d’une blessure directe ou indirecte. La perforation du diaphragme par un objet pointu ou un projectile occasionne souvent des blessures directes chez l’Homme, mais cela reste rare chez les animaux de compagnie 5,6. Une blessure indirecte se produit lorsque la compression soudaine de la cavité abdominale, alors que la glotte est ouverte, entraîne une augmentation du gradient de pression entre l’abdomen et le thorax, provoquant un étirement et une rupture ultérieure du diaphragme 7. Le muscle diaphragmatique est nettement plus fragile que le tendon central et il se rompt donc plus facilement : dans une étude portant sur 23 chats présentant une HDT, les déchirures concernaient toutes le muscle diaphragmatique 8. La hernie se produit probablement aussi souvent à gauche qu’à droite chez le chat : environ 15 % des animaux présentent des déchirures ventrales ou des sites multiples de hernie 1. Contrairement au chien, où les déchirures diaphragmatiques radiales et circonférentielles sont diagnostiquées avec la même fréquence, environ 60 % des déchirures chez le chat sont circonférentielles et seulement 20 % ont une morphologie radiale 9.
Lorsqu’une déchirure diaphragmatique est présente, les viscères abdominaux sont susceptibles de se déplacer dans la cavité thoracique (Figure 1). Les organes le plus fréquemment herniés sont le foie (55-82 % des cas), l’intestin grêle (47-71 %), l’estomac (34-53 %), la rate (32-65 %) et l’épiploon (6-58 %). Le gros intestin (6-16 %), la vésicule biliaire (0-38 %), le pancréas (0-10 %) et le rein (0-13 %) sont moins fréquemment concernés 1,2,3,8,9.
La hernie peut provoquer une atteinte cardio-respiratoire secondaire à la compression pulmonaire par les viscères abdominaux ou le liquide pleural ; elle peut aussi entraîner l’invagination ou l’étranglement des organes herniés. Une hernie hépatique peut induire une stase veineuse hépatique et une nécrose : l’obstruction de la sortie veineuse hépatique provoque l’extravasation de la lymphe et un épanchement pleural. Une invagination intestinale peut aboutir à une obstruction, tandis que la strangulation sera à l’origine de nécrose et de perforation. Une obstruction des voies biliaires extra-hépatiques peut se produire suite à une hernie de la vésicule biliaire 10. Une hernie de l’estomac peut provoquer une dilatation avec ou sans torsion 11,12 et un urothorax peut apparaître suite à une hernie rénale 13.

Figure 1. Radiographie latérale droite d’un chat montrant la disruption de la silhouette diaphragmatique (flèche bleue), le déplacement crânial du rein droit et de l’estomac (flèche verte) et le déplacement ventral des lobes pulmonaires caudaux (flèche rouge).
© Catrina Pennington
Les HDT sont surtout fréquentes chez les chats qui sortent (et qui sont donc plus exposés aux traumatismes et aux accidents) et elles sont plus souvent observées chez les chats mâles. L’âge moyen de présentation est de 2 à 5 ans, mais la fourchette d’âge des cas publiés va de 3 mois à 14 ans 1,2,3,8,9,14. Les chats européens à poil court sont le plus souvent touchés, probablement en raison de leur surreprésentation dans la population. Bien que le signalement puisse augmenter l’indice de suspicion d’une HDT, celle-ci doit être incluse dans le diagnostic différentiel chez tout animal présenté après avoir éventuellement subi un traumatisme.
Le diagnostic repose sur les commémoratifs, les signes cliniques et l’imagerie diagnostique.
La cause du traumatisme récent est parfois connue (par exemple, un accident sur la voie publique) mais elle est aussi souvent ignorée. L’affection peut être aiguë ou chronique : 20 à 30 % des animaux sont présentés plus de 14 jours après le traumatisme initial 1,2,3. Les signes de hernie apparaissent en effet progressivement si l’épiploon obture les petites déchirures, si le contenu abdominal se déplace au fil du temps en exacerbant l’atteinte respiratoire, ou si l’invagination des organes herniés et l’épanchement pleural se développent suite à la contraction et à la fibrose de l’anneau herniaire pendant la cicatrisation 15.
Dans les cas aigus, les anomalies respiratoires (dyspnée, tachypnée et cyanose) sont les signes le plus fréquemment rapportés (bien qu’aucun signe respiratoire ne soit présent dans 10 % des cas), en dehors des vomissements ou d’une anorexie 9. Dans les cas chroniques, les commémoratifs sont plus variés : une dyspnée ou une tachypnée est rapportée chez presque la moitié des chats tandis qu’un tiers présentent des signes gastro-intestinaux (anorexie, constipation ou vomissements). La tachypnée ou la dyspnée sont absentes chez 50 % des chats présentant une HDT chronique avec des signes gastro-intestinaux, tandis que la toux constitue le motif de consultation dans 13 % des cas. Enfin, 19 % des cas chroniques sont découverts de manière fortuite, alors que le chat était examiné pour d’autres raisons 14.
Dans plus de 70 % des cas aigus, une tachypnée ou une dyspnée sont présentes à l’examen. Des bruits cardiaques étouffés, des bruits pulmonaires augmentés ou diminués, une difficulté à palper l’abdomen, des douleurs abdominales, une hypothermie et une posture orthopnéique sont des signes cliniques moins fréquents 1,2,9. Dans les cas aigus, des signes cliniques liés au choc hypovolémique peuvent également apparaître, comme la tachycardie, un faible pouls périphérique, un temps de remplissage capillaire allongé, un état de conscience altéré et une pâleur des muqueuses. L’état de l’animal doit alors être correctement stabilisé avant de poursuivre les examens.
Dans les situations de HDT chronique, une diminution des bruits cardiaques ou pulmonaires est notée lors de 75 % des examens cliniques (Figure 2) alors que seulement 56 % des chats affectés sont tachypnéiques ou dyspnéiques 14. Des lésions concomitantes des tissus mous sont observées chez environ 40 % des chats avec une HDT 2 : leur présence (ainsi que d’autres signes de traumatisme, tels que des griffes abîmées, des dents cassées et des lésions orthopédiques) augmente le niveau de suspicion de HDT dans les cas où les commémoratifs complets font défaut.

Figure 2. Lors de hernie diaphragmatique traumatique chronique, une diminution des bruits du cœur ou des poumons pourra être observée dans 75 % des cas. Il est donc conseillé d’ausculter attentivement le thorax pendant l’examen clinique.
© Shutterstock
Des radiographies thoraciques orthogonales doivent être réalisées sur tout chat suspecté d’avoir subi un traumatisme grave (Figure 3). En positionnant l’animal, il faut veiller à éviter tout geste susceptible d’aggraver l’atteinte respiratoire ; les chats doivent donc être manipulés avec douceur et précaution. Dans de nombreux cas, une anesthésie générale, permettant de sécuriser les voies respiratoires par intubation endotrachéale, est préférable à une contention lourde ou à une sédation.
 |
| a |
 |
| b |
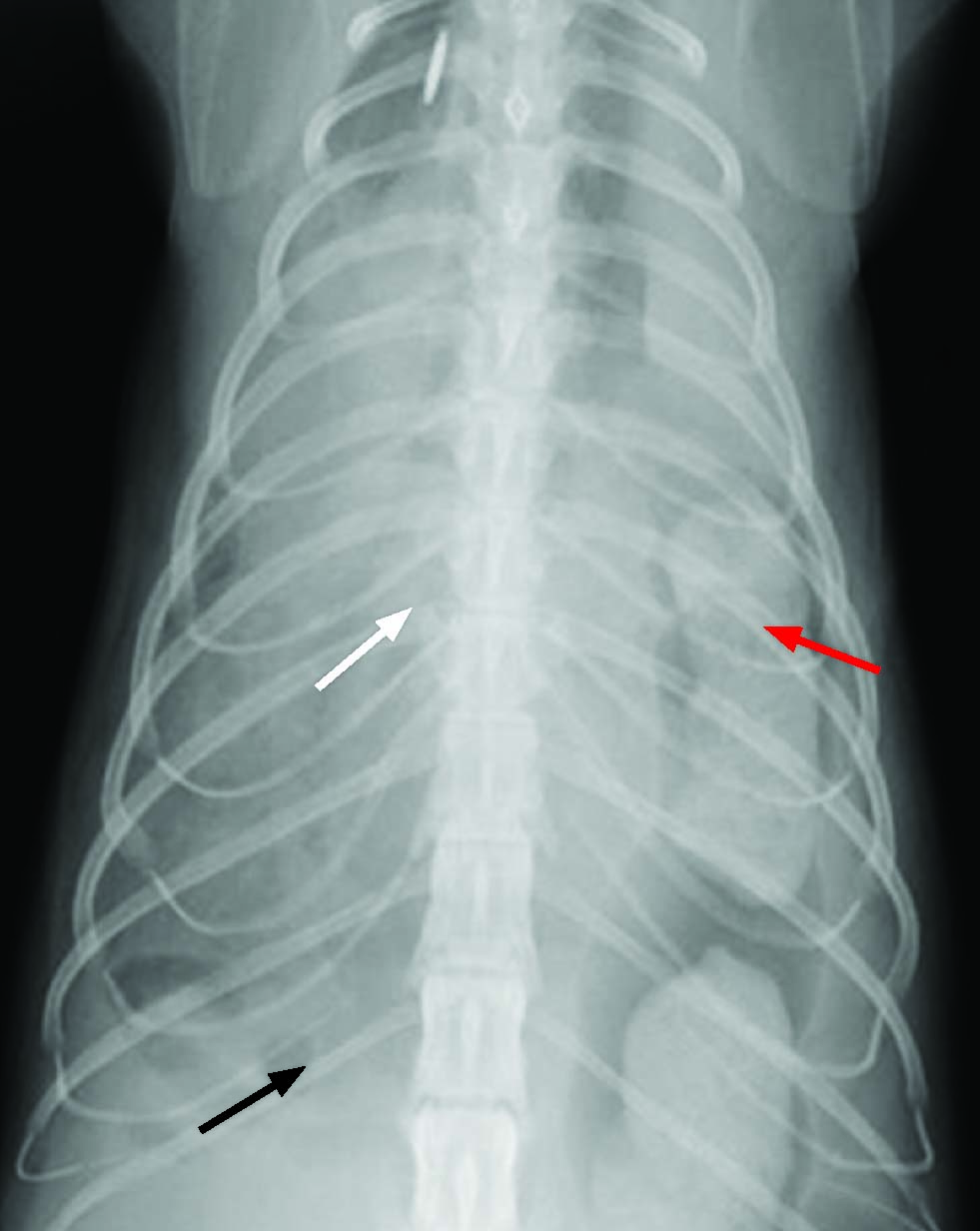
Figure 3. Des radiographies thoraciques orthogonales doivent être prises chez tout chat suspecté d’avoir subi un traumatisme grave. Ici, les vues dorsoventrale (a) et latérale droite (b) d’un chat montrent la disparition de la ligne diaphragmatique normale (flèches noires), avec effacement de la silhouette cardiaque (flèches blanches) et migration étendue des organes abdominaux dans la cavité thoracique (flèches rouges).
© Catrina Pennington
Les radiographies thoraciques latérales révèlent des anomalies de la silhouette diaphragmatique normale chez presque 97 % des chats 16, mais il est important de se rappeler que la cause peut être autre qu’une HDT (par exemple, une hernie diaphragmatique périto-néopéricardique congénitale). La densité des tissus mous et des liquides thoraciques peut être accrue, et des lignes de fissure pleurale seront présentes en cas d’épanchement pleural (Figure 4). Un déplacement crânial du foie ou de l’estomac, un effacement de la silhouette cardiaque, une densité accrue des lobes pulmonaires ventraux, l’ombre des gaz intestinaux dans le thorax et une réduction du volume pulmonaire peuvent également être observés 9. Des signes radiographiques de blessures orthopédiques concomitantes sont rapportés chez 14 % des chats 9, avec des fractures des côtes dans 6 % des cas 14.
Une étude a montré que la sensibilité de l’échographie thoracique pour diagnostiquer une hernie diaphragmatique atteint 90 % : le diagnostic s’appuyait sur l’identification du contenu abdominal dans la cavité thoracique et la perte de la ligne diaphragmatique 14 (Figure 5). L’échographie est une technique utile pour les animaux chez qui l’épanchement pleural complique le diagnostic radiographique.

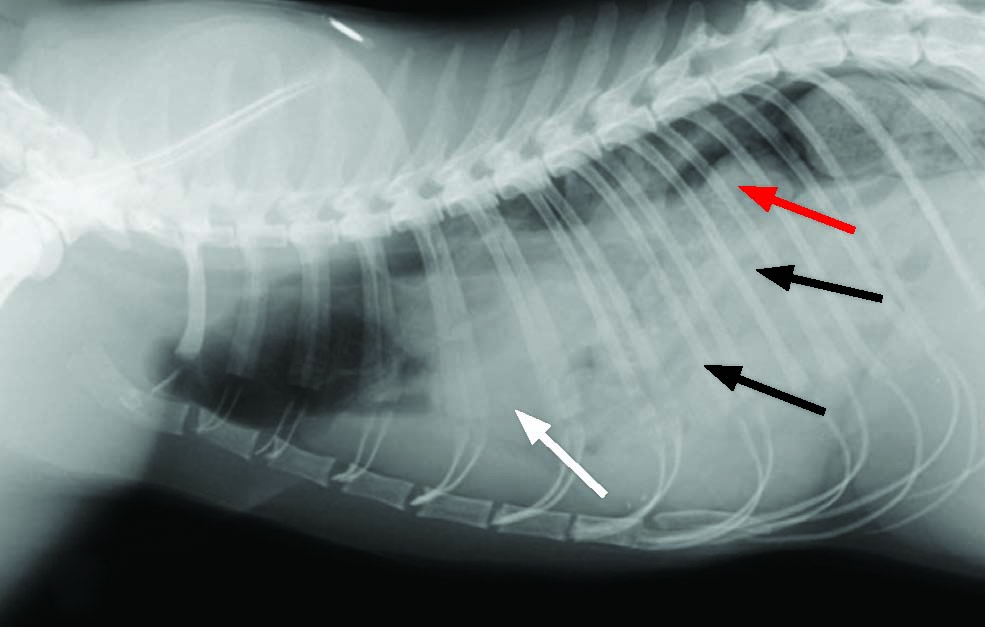
Figure 4. Radiographie latérale gauche d’un chat montrant la disparition de la ligne diaphragmatique normale, l’effacement de la silhouette cardiaque (flèche bleue) et la présence de tissus mous ou de fluides opaques dans le thorax et l’abdomen, correspondant à un épanchement pleural et péritonéal (flèches vertes).
© Catrina Pennington

Figure 5. Image échographique d’un chat montrant la rupture de l’interface poumon-diaphragme et la présence de tissu hépatique dans le thorax.
© Catrina Pennington
Des examens hématologiques et de biochimie sérique de routine doivent être effectués pour orienter la stabilisation préopératoire (par exemple, pour déterminer si une transfusion est nécessaire). L’hématologie peut révéler une anémie et une leucocytose avec ou sans décalage vers la gauche. La biochimie sérique peut révéler diverses anomalies électrolytiques, une élévation de l’alanine aminotransférase (ALT), de l’aspartate aminotransférase (AST), de la phosphatase alcaline (ALP) et de la bilirubine, en association avec une hernie hépatique 1,9,14 et une hypoprotéinémie 1,14.
Bien que des études anciennes aient mentionné que le pronostic était moins bon chez les animaux opérés dans les 24 heures suivant le traumatisme, ainsi que chez ceux opérés plus d’un an après la hernie, aucune association significative entre les chances de survie et le moment de l’intervention chirurgicale après le traumatisme initial n’a été observée dans des études récentes 1,2. En conséquence, et à cause du risque de décompensation respiratoire en cas de hernie progressive des organes abdominaux ou de dilatation d’un estomac hernié, il est actuellement recommandé d’opérer rapidement : dès que le choc, l’hypoxie, l’hypovolémie, l’hémorragie, les contusions pulmonaires et les arythmies cardiaques sont suffisamment contrôlés pour anesthésier le chat en toute sécurité.
Les animaux doivent être prémédiqués avec un agent approprié avant d’induire l’anesthésie. Le protocole dépendra du chat à anesthésier et de l’expérience du clinicien, mais les benzodiazépines et les opioïdes sont couramment utilisés 17. Il est important de surveiller étroitement le chat après l’administration de la prémédication, car une détérioration soudaine de la fonction respiratoire peut survenir suite à un changement de position. Il est fortement recommandé de préoxygéner avant l’induction, et l’administration d’un flux d’oxygène est généralement mieux tolérée que l’utilisation d’un masque facial. L’anesthésie générale sera induite par l’injection d’un agent à action rapide et elle sera entretenue grâce à un anesthésique volatil délivré avec l’oxygène. La fonction diaphragmatique normale est nécessaire à la ventilation spontanée sous anesthésie générale, d’où la nécessité d’une ventilation à pression positive intermittente. Dans les voies aériennes, la pression doit être maintenue autour de 15 cm H2O 18, et la manométrie est recommandée pour réduire le risque de volutraumatisme par inadvertance.
Alistair Freeman
Le chat sera placé en décubitus dorsal, et sa face ventrale sera préparée et désinfectée du milieu du thorax jusqu’à la partie caudale du pubis. Cela permet de pratiquer une sternotomie caudale ou une extension caudale de la céliotomie si nécessaire. La table d’opération sera si possible inclinée pour relever la tête du chat et favoriser le déplacement caudal du contenu abdominal. Cela améliore l’accessibilité au diaphragme, la ventilation et facilite la réduction des viscères herniés 6.
La liste du matériel recommandé figure dans l’Encadré 1. Une céliotomie ventrale de la ligne médiane sera effectuée depuis le processus xiphoïde jusqu’à mi-chemin entre l’ombilic et le pubis. Une sternotomie médiane est rarement indiquée mais elle peut être nécessaire pour mieux exposer le diaphragme et des viscères herniés, soit dans les cas chroniques où des adhérences thoraciques se sont formées, soit dans les cas de traumatisme thoracique concomitant. Le ligament falciforme doit être excisé et des écarteurs auto-rétentifs appropriés, tels que les écarteurs abdominaux de Balfour ou de Gosset (Figure 6), seront mis en place pour améliorer la visualisation de la partie antérieure de l’abdomen. Le contenu de l’abdomen antérieur sera repoussé caudalement et latéralement (ou extériorisé) pour mieux visualiser le diaphragme et localiser la hernie. Des compresses abdominales humidifiées avec du sérum physiologique stérile sont utiles pour protéger les organes pendant la rétraction, et la procédure sera facilitée par la présence d’un assistant chirurgical. Même si une lésion diaphragmatique apparaît dès la première inspection, le diaphragme doit être entièrement et minutieusement exploré, car des déchirures bilatérales ou multiples sont fréquentes ; les déchirures dorsales et celles au niveau du hiatus aortique passent facilement inaperçues car elles sont cachées par le foie 5.
Encadré 1. Matériel nécessaire lors d’une intervention chirurgicale destinée à traiter une hernie diaphragmatique traumatique.
|

Figure 6. L’utilisation d’écarteurs auto-rétentifs de Balfour améliore la visualisation de l’abdomen antérieur.
© Catrina Pennington
Une traction douce sera appliquée pour remettre en place les viscères herniés. Il faut les manipuler prudemment pour éviter les lésions : le foie et la rate, en particulier, peuvent être engorgés et friables. Parfois, la réduction de certains viscères herniés pose problème à cause de la formation d’un œdème ou d’adhérences à la plèvre ; dans ce cas, un meilleur accès au thorax caudal sera obtenu grâce à une incision du diaphragme pour élargir l’anneau herniaire (en évitant de sectionner les nerfs phréniques ou de traumatiser les structures traversant le diaphragme) ou en effectuant une sternotomie caudale. Les adhérences fibrineuses récentes peuvent être cassées en les manipulant doucement. Cela limite le risque d’hémorragie. Les adhérences présentes depuis plus de 1 à 2 semaines peuvent être enlevées par une dissection tranchante, un cautère ou une section de l’organe impliqué en utilisant une technique appropriée 19. Une fois les organes ramenés dans l’abdomen, ils seront inspectés pour vérifier l’absence de rupture, de nécrose, de torsion ou d’autres lésions ; les tissus endommagés seront réparés ou réséqués si nécessaire. La cavité thoracique sera soigneusement lavée avant l’herniorraphie.
Le débridement des bords de l’anneau herniaire n’est nécessaire que dans les cas chroniques où il existe des adhérences entre le diaphragme et les viscères herniés. Le trou sera fermé avec un monofil synthétique et non résorbable, selon un schéma de suture discontinu ou continu : la seconde option limite le risque de blesser des viscères abdominaux avec les extrémités coupées du fil. Le fait de préparer les sutures les plus dorsales et de commencer la suture à l’extrémité dorsale (la plus profonde) de la hernie facilite la visualisation. Lors de la suture de déchirures impliquant le hiatus aortique ou œsophagien ou le foramen quadrilatère, il est important d’éviter de rétrécir ces structures en plaçant soigneusement les sutures et en prenant de plus petits morceaux de tissu. Une tension excessive est rarement un problème pour réparer des déchirures simples et aiguës ; dans les déchirures plus complexes ou chroniques, un rapprochement temporaire avec des sutures de maintien peut cependant faciliter la fermeture. Les lésions très importantes peuvent ne pas se prêter à une fermeture primaire ; la fermeture sera alors complétée en utilisant des lambeaux de muscles ou d’omentum, une greffe autogène ou des implants synthétiques 20,21,22,23,24,25.
La mise en place d’une sonde de thoracostomie permet d’évacuer le pneumothorax résiduel avant de réaliser la suture diaphragmatique finale ; la sonde sera connectée à un robinet à trois voies, et l’air sera évacué par aspiration douce jusqu’à obtenir une pression légèrement négative (Figure 7). Une autre solution consiste à insérer une sonde de thoracostomie ou une sonde d’alimentation de calibre étroit à travers la lésion diaphragmatique avant le serrage final des sutures ; l’extrémité doit alors sortir par l’incision de céliotomie pour permettre le drainage postopératoire du pneumothorax si nécessaire.

Figure 7. Un tube de thoracostomie relié à un robinet à trois voies permet d’évacuer un pneumothorax résiduel après l’opération.
© Catrina Pennington
Tenter d’éliminer le pneumothorax en gonflant excessivement les poumons à la fermeture peut entraîner une hémorragie et un œdème pulmonaires. Une réexpansion rapide des poumons augmente le risque de lésions de reperfusion et le regonflage doit donc être progressif. De plus, une expansion excessive ou prolongée des poumons après la fermeture de la lésion diaphragmatique accroît la pression intrathoracique, ce qui augmente la résistance au retour veineux et entraîne une baisse du débit cardiaque. Les lobes atélectasiques qui ne se regonflent pas après la ventilation mécanique à une pression physiologique seront traités en postopératoire par un drainage via un cathéter thoracique, en visant une pression légèrement négative. Le regonflage progressif réduit le risque de lésions de reperfusion.
L’abdomen sera enfin lavé avec du sérum physiologique stérile avant de procéder aux sutures habituelles. Pour aider à rétablir un gradient de pression pleuro-péritonéal normal, il faut évacuer l’air de l’abdomen en appliquant une légère pression pendant la fermeture de la ligne blanche.
Avant le réveil de l’anesthésie, placer le chat à la fois en décubitus latéral et sternal, et aspirer dans le tube de thoracostomie jusqu’à obtenir une pression légèrement négative. Laisser le tube en place jusqu’à ce que la production soit inférieure à 0,5 mL/kg de liquide et 1 mL/kg d’air sur 24 heures 8.
Les signes vitaux du chat (fréquence et profil respiratoires, couleur des muqueuses, temps de remplissage capillaire, température rectale) doivent être étroitement surveillés après l’opération, et on utilisera une grille d’appréciation objective de la douleur afin de s’assurer que l’analgésie est adéquate. Ce point est essentiel, car la douleur peut être à l’origine d’une hypoventilation et d’une hypoxie secondaire à l’expansion thoracique réduite. La fluidothérapie intraveineuse sera maintenue jusqu’à la reprise de l’alimentation spontanée et d’autres soins de soutien (par exemple, réchauffement actif et oxygène supplémentaire) pourront éventuellement être fournis.
Jusqu’à 50 % des chats présentent des complications après une herniorraphie 1 ; il s’agira notamment d’une infection du site chirurgical, d’une déhiscence de la plaie chirurgicale ou du site de l’herniorraphie, d’une hémorragie tardive, de dysrythmies cardiaques, d’une rupture d’organe, d’un arrêt cardiaque, d’un pneumothorax ou d’un œdème pulmonaire de regonflement 1,2,3,8,9,14. Le pneumothorax dû à un traumatisme iatrogène des poumons pendant la rupture des adhérences, ou secondaire à une blessure lors du regonflage, est une complication rare 14. Les cas bénins peuvent se résoudre d’eux-mêmes, mais une lobectomie pulmonaire sera parfois nécessaire pour traiter une fuite persistante. Le syndrome compartimental abdominal est une préoccupation chez le chien et chez l’Homme après une herniorraphie, mais il n’a pas été documenté chez le chat.
Les causes les plus fréquentes de décès en postopératoire sont l’arrêt cardiaque 1 et l’œdème pulmonaire de réexpansion 8,9. L’œdème résulterait d’une augmentation de la perméabilité capillaire alvéolaire, due à la fois à un surgonflage pulmonaire et à une inflammation liée à une lésion de reperfusion 26. Les chats concernés seront supplémentés en oxygène, traités avec des diurétiques et des bronchodilatateurs, mais le pronostic est réservé.
Entre 85,3 et 100 % des chats atteints de HDT survivent jusqu’à pouvoir sortir de la clinique 1,2,3,8. Un âge avancé, une fréquence respiratoire basse lors de la présentation, des lésions concomitantes 1 et un temps opératoire plus long 3 sont associés à un moins bon pronostic. Les animaux qui restent dépendants de l’oxygène pendant toute leur hospitalisation présentent 5 fois plus de risques de décès en postopératoire, et le facteur de risque est même multiplié par 7,3 chez ceux qui présentent aussi des lésions des tissus mous ou orthopédiques. Comme cela a déjà été dit, le moment de l’opération n’a pas été systématiquement associé à la mortalité, et les taux de survie rapportés après correction chirurgicale des hernies chroniques atteignent 100 % 14.
Catrina Pennington
La hernie diaphragmatique traumatique doit être incluse dans le diagnostic différentiel chez tout chat présentant une lésion traumatique connue ou suspectée, en particulier ceux qui présentent des anomalies respiratoires. Les signes gastro-intestinaux peuvent primer dans les cas chroniques, mais une auscultation thoracique attentive détectera des anomalies chez ces animaux. La radiographie est la technique d’imagerie à privilégier et elle se justifie chez tout chat présenté après un traumatisme, ainsi que chez les animaux chez qui l’auscultation thoracique révèle une augmentation ou une diminution des bruits respiratoires. La chirurgie sera pratiquée dès que l’état du chat sera stable. Le chirurgien et le propriétaire doivent être prêts à fournir des soins intensifs après l’intervention. Le pronostic est cependant généralement bon, les principales causes de mortalité postopératoire étant l’arrêt cardiaque et l’œdème pulmonaire de réexpansion.
Schmiedt CW, Tobias KM, Stevenson MA. Traumatic diaphragmatic hernia in cats: 34 cases (1991-2001). J. Am. Vet. Med. Assoc. 2003;222(9):1237-1240.
Gibson TW, Brisson BA, Sears W. Perioperative survival rates after surgery for diaphragmatic hernia in dogs and cats: 92 cases (1990-2002). J. Am. Vet. Med. Assoc. 2005;227(1):105-109.
Legallet C, Thieman Mankin K, Selmic LE. Prognostic indicators for perioperative survival after diaphragmatic herniorrhaphy in cats and dogs: 96 cases (2001-2013). BMC Vet. Res. 2017;13(1):16.
Evans H, de Lahunta A. Miller’s Anatomy of the Dog 4th ed. St Louis: Elsevier Saunders; 2013;250-252.
Caywood D. Non-cardiac surgical diseases of the thorax. Vet. Clin. North Am. Small Anim. Pract. 1987;17(2):255-270.
Rashid F, Chakrabarty MM, Singh R, et al. A review on delayed presentation of diaphragmatic rupture. World J. Emerg. Surg. 2009;4:32.
Sangster G, Ventura VP, Carbo A, et al. Diaphragmatic rupture: a frequently missed injury in blunt thoracoabdominal trauma patients. Emerg. Radiol. 2007;13(5):225-230.
Sullivan M, Reid J. Management of 60 cases of diaphragmatic rupture. J. Small Anim. Pract. 1990;31:425-430.
Garson HL, Dodman NH, Baker GJ. Diaphragmatic hernia; analysis of fifty-six cases in dogs and cats. J. Small Anim. Pract. 1980;21(9):469-481.
Cornell K, Jakovljevic S, Waters D, et al. Extrahepatic biliary obstruction secondary to diaphragmatic hernia in two cats. J. Am. Anim. Hosp. Assoc. 1993;29;502-507.
Formaggini L, Schmidt K, De Lorenzi D. Gastric dilatation-volvulus associated with diaphragmatic hernia in three cats: clinical presentation, surgical treatment and presumptive aetiology. J. Feline Med. Surg. 2008;10(2):198-201.
Bredal WP, Eggertsdottir AV, Austefjord O. Acute gastric dilatation in cats: a case series. Acta Vet. Scand. 1996;37(4):445-451.
Stork CK, Hamaide AJ, Schwedes C, et al. Hemiurothorax following diaphragmatic hernia and kidney prolapse in a cat. J. Feline Med. Surg. 2003;5(2):91-96.
Minihan AC, Berg J, Evans KL. Chronic diaphragmatic hernia in 34 dogs and 16 cats. J. Am. Anim. Hosp. Assoc. 2004;40(1):51-63.
Boudrieau S, Muir W. Pathophysiology of traumatic diaphragmatic hernia in dogs. Comp. Cont. Educ. Pract. Vet. 1987;9:379.
Sullivan M, Lee R. Radiological features of 80 cases of diaphragmatic rupture. J. Small Anim. Pract. 1989;30;561-566.
Wilson DV: Anesthesia for patients with diaphragmatic hernia and severe dyspnea. Vet. Clin. North. Am. Small Anim. Pract. 1992;22(2):456-459.
Dyson DH. Positive pressure ventilation during anesthesia in dogs: Assessment of surface area derived tidal volume. Can. Vet. J. 2012;53(1):63-66.
Henderson RA. Controlling peritoneal adhesions. Vet. Surg. 1982;11;30-33.
Rosenkrantz J, Cotton E. Replacement of left hemidiaphragm by a pedicled abdominal muscular flap. J. Thorac. Cardiovasc. Surg. 1964;48;912-920.
Touloukian R. A “new” diaphragm following prosthetic repair of experimental hemidiaphragmatic defects in the pup. Ann. Surg. 1978;187;47-51.
Schairer B, Keeley J. Experimental use of homologous fascia lata to repair diaphragmatic defects in dogs. Surg. Gynecol. Obstet. 1957;105;564-568.
Bright R, Thacker H. The formation of an omental pedicle flap and its experimental use in the repair of a diaphragmatic rent in the dog. J. Am. Anim. Hosp. Assoc. 1982;18;283-289.
Neville W, Clowes G. Congenital absence of hemidiaphragm and use of a lobe of liver in its surgical correction. Arch. Surg. 1954;69;282-290.
Furneaux R, Hudson M. Autogenous muscle flap repair of a diaphragmatic hernia. Feline Pract. 1976;6;20-24.
Sivrikoz MC, Tuncozgur B, Cekmen M, et al. The role of tissue reperfusion in the re-expansion injury of the lungs. Eur. J. Cardiothorac. Surg. 2002;22(5):721-727.
Alistair Freeman
Le Dr Freeman est diplômé de l’Université d’Édimbourg, où il a aussi effectué un résidanat, depuis 1994 En savoir plus
Catrina Pennington
La Dre Pennington est diplômée de l’Université d’Édimbourg depuis 2014 et a d’abord travaillé en clientèle pour animaux de compagnie avant d’entreprendre un internat, incluant un stage en orthopédie dans un hôpital vétérinaire spécialisé privé En savoir plus
Cet article montre que les nématodes pulmonaires et cardiaques sont sous-estimés alors que ces parasites représentent une grave menace pour de nombreux chats.
Le chylothorax est à inclure dans le diagnostic différentiel chez tout chat présentant un épanchement pleural. Elizabeth Rozanski décrit ici l’approche qu’elle privilégie dans de tels cas.
L’asthme est une maladie fréquente chez le chat mais qui peut ressembler à de nombreuses autres maladies. Cet article montre à quel point le diagnostic et le traitement de cette affection peuvent être délicats.
Le lymphome est l’une des maladies cancéreuses les plus fréquentes chez le chat. James Elliott fait notamment remarquer que la forme médiastinale est à inclure dans le diagnostic différentiel lorsqu’un chat présente des signes respiratoires.
