Les nématodes pulmonaires et cardiaques du chat
Cet article montre que les nématodes pulmonaires et cardiaques sont sous-estimés alors que ces parasites représentent une grave menace pour de nombreux chats.
Cet article contient des photos qui peuvent choquer la sensibilité des enfants
Numéro du magazine 32.2 Cardiologie
Publié 26/10/2022
Aussi disponible en Deutsch , Italiano , Español , English et Українська
Comment traiter un chat qui est sujet à des syncopes ? Luca Ferasin guide ici le clinicien dans une approche méthodique indispensable au succès.
Nous remercions les Drs Antoine Dubès et Pierre Menaut pour leur relecture attentive de la version française de cet article.
© Shutterstock

Les syncopes apparaissent brutalement et sont de courte durée. La récupération est spontanée et complète, bien qu’une désorientation transitoire puisse être observée pendant quelques minutes dans certains cas.
La syncope chez le chat est généralement associée à une maladie cardiovasculaire primaire, mais d’autres affections peuvent être impliquées.
L’approche thérapeutique d’un chat souffrant de syncope dépend largement de la cause sous-jacente et la nature transitoire des épisodes syncopaux rend le diagnostic particulièrement délicat.
L’épilepsie est souvent diagnostiquée à tort chez les chats présentant des syncopes, et cela peut entraîner des examens diagnostiques coûteux et inutiles.
La syncope est définie comme une perte de conscience soudaine, inattendue et non provoquée par un événement extérieur, suivie d’une récupération spontanée. Les chats affectés perdent leur contrôle postural, tombent au sol et restent sans réaction pendant toute la durée de l’événement. Cependant, la syncope est un état transitoire, qui dure généralement quelques secondes, et elle est toujours suivie d’un rétablissement complet. Chez l’Homme, les syncopes peuvent être précédées de palpitations, de vertiges, d’étourdissements, de sueurs, de nausées ou de troubles visuels. Pour des raisons évidentes, ces signes avant-coureurs ne sont pas observés chez les animaux et ne sont donc pas signalés chez les chats sujets à des syncopes. Certains propriétaires mentionnent cependant que leur chat vocalise ou miaule juste avant l’événement. Un épisode de syncope peut ressembler à une mort subite et les personnes qui en sont témoins sont souvent très inquiètes. La situation s’apparente à la détresse des parents lorsqu’ils voient leur enfant s’évanouir : ils sont stressés et anxieux car ils se sentent incapables d’aider ou de porter assistance. De plus, chez les chats ayant des antécédents de syncope, le risque de mort subite est accru 1. Certains chats présentent occasionnellement des épisodes plus modérés et montrent des signes de pré-syncope (ou lipothymie) caractérisés par une chute, une faiblesse ou une démarche instable, mais sans perte complète de conscience. L’approche diagnostique et la gestion clinique de ces cas seront néanmoins identiques aux procédures d’investigation et de traitement des syncopes complètes.
Bien que plusieurs phénomènes puissent entraîner une syncope, celle-ci résulte finalement d’une hypoperfusion cérébrale globale et transitoire. Chez l’Homme, indépendamment de la cause sous-jacente, un arrêt soudain du flux sanguin cérébral pendant 6 à 8 secondes ou une chute de la pression artérielle systolique en dessous de 60 mmHg sont suffisants pour provoquer une perte de conscience complète 2. Les valeurs physiologiques critiques pouvant provoquer une syncope chez le chat ne sont pas disponibles mais il est logique de penser que le phénomène pourrait s’apparenter à ce qui est observé chez l’Homme.
La syncope féline est souvent associée à des maladies cardio-vasculaires primaires, bien que d’autres affections figurent également dans la liste du diagnostic différentiel. Des causes orthostatiques, métaboliques et psychologiques sont souvent évoquées comme des causes d’évanouissement chez l’Homme mais ne sont pas habituellement décrites en médecine vétérinaire. Une dilatation artérielle iatrogène peut se produire après l’administration de médicaments vasodilatateurs, comme le nitroprussiate, l’acépromazine ou l’amlodipine. Toutes les anomalies énumérées peuvent induire une hypoperfusion cérébrale puis une perte de connaissance ultérieure. Un résumé des causes potentielles de syncope figure dans le Tableau 1.
Tableau 1. Étiologies des syncopes chez le chat.
| Cardio-vasculaires |
|
| Vasculaires |
|
| Non cardio-vasculaires |
|
* Hypothèses non confirmées chez le chat.
Dans la littérature vétérinaire, les cas de syncope féline rapportés sont associés à des variations pathologiques du rythme cardiaque, telles que des périodes prolongées de bradycardie dues à un arrêt sinusal 3 ou un bloc atrio-ventriculaire (BAV) paroxystique avec asystolie ventriculaire 4. Des cas de syncope féline peuvent également accompagner une tachycardie ventriculaire (TV) 5,6 ou supraventriculaire (TSV) 7 paroxystique. Un épisode de crise de tétanie, probablement associé à une tachycardie atriale paroxystique, a été décrit chez un chat Persan, mais l’association entre la syncope et la tachycardie n’a pas été démontrée dans ce cas 8. D’autres causes de syncopes chez les chats ont été évoquées : obstruction à l’éjection ventriculaire droite secondaire à une dirofilariose cardiaque 9, augmentation de la pression intrathoracique et intra-abdominale entraînant une réduction du retour veineux pendant la défécation (syncope situationnelle) 10, anévrisme aortique disséquant associé à une hypertension artérielle systémique 11 et anomalies cardiaques congénitales 12. À la connaissance de l’auteur, la syncope vasovagale (neurocardiogénique), l’une des causes les plus fréquentes de syncope chez l’Homme, n’a jamais été décrite dans la littérature chez le chat, bien que l’auteur ait documenté quelques cas au cours de son activité clinique.
Le cerveau a besoin d’un débit sanguin cérébral constant et adéquat pour fonctionner ; toute réduction ou interruption significative, même pendant quelques secondes, peut entraîner une syncope. Le flux sanguin cérébral est maintenu par divers mécanismes affectant la pression artérielle (PA), qui est le résultat du débit cardiaque (DC) multiplié par la résistance périphérique totale (RPT) (c’est-à-dire PA = DC x RPT). À son tour, le DC est déterminé par le volume de sang pompé par le cœur (volume systolique, VS) par unité de temps (fréquence cardiaque : FC) (c’est-à-dire DC = VS x FC). Par conséquent, des modifications du VS, de la FC ou de la RPT affecteront la pression artérielle systémique et donc la perfusion cérébrale.

Figure 1. Relation entre le débit cardiaque (DC) et la fréquence cardiaque (FC) 26. L’intervalle N représente les variations physiologiques de la FC (à l’effort, par exemple) ; le DC ne change presque pas car l’augmentation de la FC réduit le volume systolique (VS) de manière équilibrée (DC = VS x FC). Cependant, lorsque la FC augmente au-delà de la fourchette physiologique (intervalle T = tachycardie), la durée de la diastole diminue de manière significative et devient insuffisante pour assurer un remplissage ventriculaire et un VS adéquats, limitant ainsi le DC. A contrario, lorsque la FC diminue excessivement (intervalle B = bradycardie), le remplissage ventriculaire, malgré une diastole prolongée, n’augmente pas proportionnellement car la compliance ventriculaire est limitée, ce qui altère le VS et enfin le DC.
© Luca Ferasin
Les variations physiologiques de la FC ont peu d’effet sur le DC. En effet, lorsque la FC augmente, le VS diminue en conséquence puisque la durée de la diastole est raccourcie. Le temps disponible pour le remplissage ventriculaire est alors plus court et le volume de sang éjecté par le cœur lors de la contraction suivante diminue. À l’inverse, une réduction physiologique de la FC s’accompagne d’une augmentation de la durée de la diastole et du remplissage ventriculaire associé, entraînant une augmentation du VS. Cependant, si l’évolution de la FC devient pathologique (provoquant tachycardie ou bradycardie), le DC diminue significativement dans les deux cas. En effet, une tachycardie importante et soutenue peut réduire de façon critique la durée de la diastole au point d’affecter gravement le VS. Inversement, une bradycardie profonde peut conduire à une réduction du DC malgré l’augmentation du remplissage ventriculaire (Figure 1). Des exemples de syncopes induites par une tachycardie de fréquence élevée et une bradycardie profonde sont respectivement décrits dans les Figures 2 et 3.
 |
| a |
 |
| b |
 |
| c |
Figure 2. Chat Devon Rex mâle de 9 ans, stérilisé, référé avec une longue histoire d’épisodes syncopaux, survenant approximativement tous les 3-4 mois. Les enregistrements ECG au repos, un Holter de 24 heures, les radiographies thoraciques et les échocardiogrammes n’ont pas été concluants. Un enregistreur à boucle implantable (a) a donc été inséré chirurgicalement en sous-cutané sur le côté gauche de la poitrine pour permettre une surveillance continue de l’ECG (b). Quelques semaines plus tard, le chat a connu un nouvel épisode de syncope et le propriétaire a réussi à déclencher le dispositif d’activation de l’appareil. Le tracé ECG pendant l’épisode syncopal a montré une tachycardie supraventriculaire (TSV) rapide à une fréquence de 430 bpm (pointe de flèche noire) (c). Le chat a reçu du sotalol (10 mg PO BID) et n’a plus présenté d’épisodes de syncope.
© Luca Ferasin

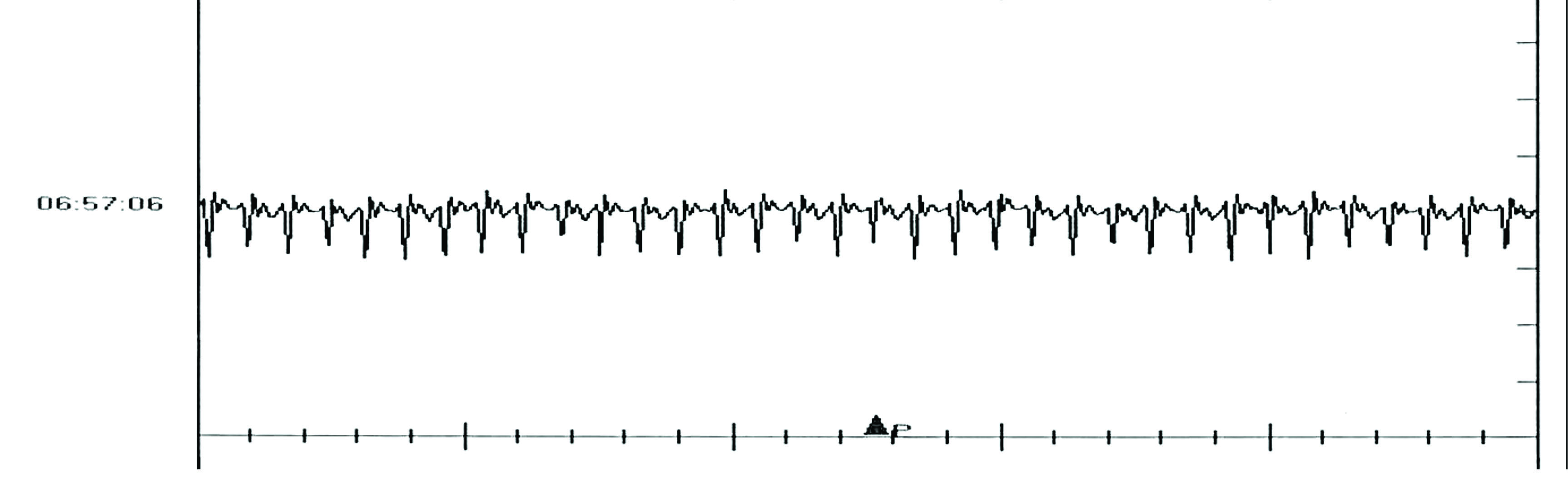
Figure 3a. Chat Européen femelle stérilisé de 11 ans, initialement référé pour un bilan neurologique suite à l’apparition quotidienne de tremblements, de contractions faciales et de syncopes. Des pauses cardiaques prolongées ont été détectées lors de l’examen clinique, qui ont conduit à un bilan cardiaque immédiat. L’échocardiographie, la radiographie thoracique et l’ECG au repos n’ont pas mis en évidence d’anomalie, mais un monitoring Holter de 24 heures a révélé un rythme sinusal prédominant, alternant avec des périodes de dissociation atrio-ventriculaire (AV), avec une fréquence quotidienne moyenne de 93 bpm. Les épisodes de syncope et de contraction coïncidaient avec des périodes de BAV de grade 3 avec asystolie ventriculaire, la période la plus longue durant environ 8 secondes.
© Luca Ferasin

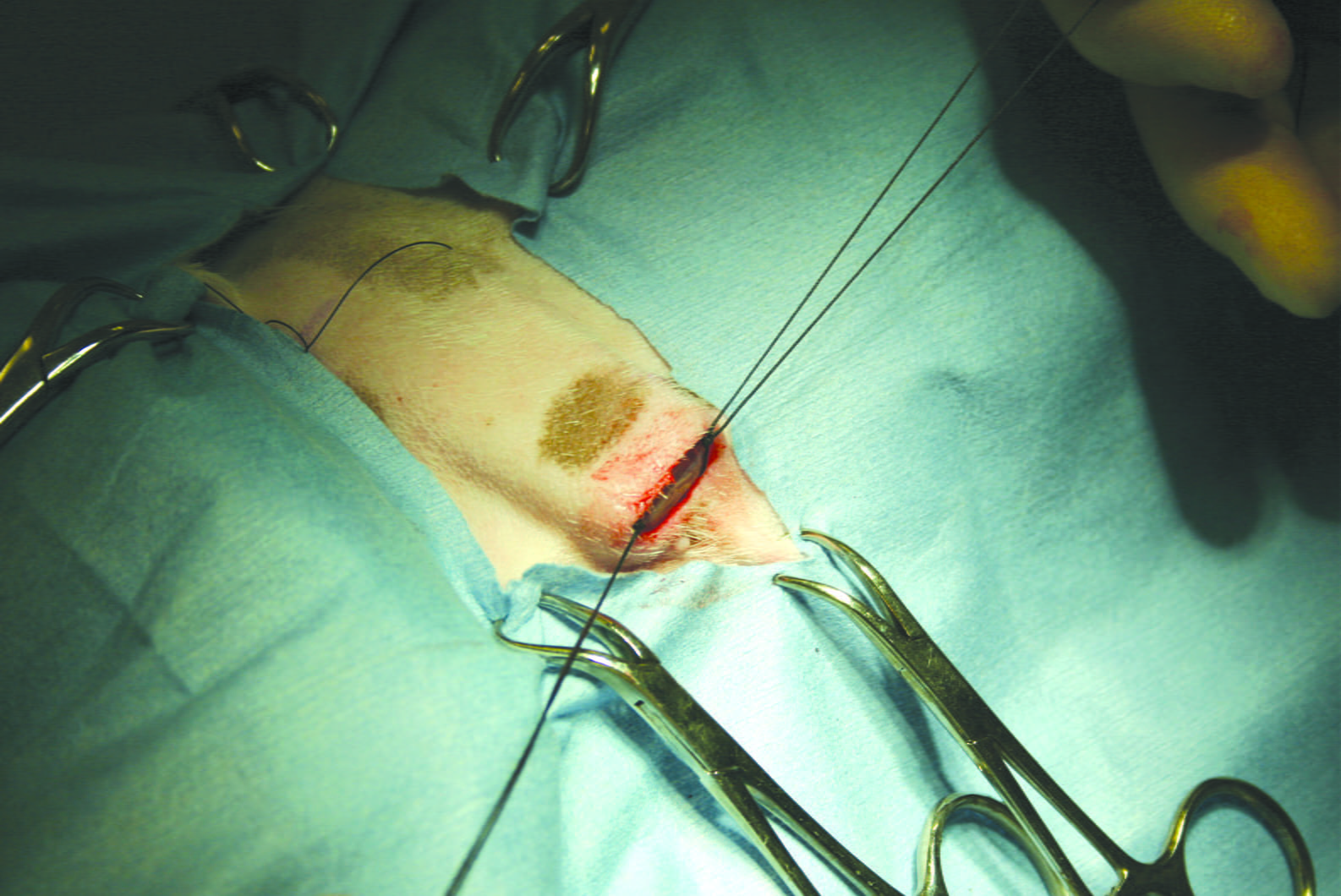
Figure 3b. Un pacemaker permanent a été implanté chirurgicalement, la sonde étant fixée sur l’épicarde du ventricule gauche.
© Luca Ferasin

Figure 3c. La sonde épicardique a été insérée sous les muscles de la paroi thoracique latérale, et le générateur d’impulsions a été placé dans une poche sous-cutanée créée sur la paroi abdominale crânio-ventrale gauche.
© Luca Ferasin

Figure 3d. Les épisodes syncopaux n’ont pas réapparu après l’intervention. L’analyse du dispositif, effectuée six mois plus tard, a révélé que le pacemaker fonctionnait pendant 24 % du temps afin d’éviter les pauses cardiaques et les syncopes associées.
© Luca Ferasin
Le mécanisme physiopathologique de la syncope secondaire à la présence d’un obstacle à l’éjection ventriculaire est assez intuitif puisque toute maladie clinique qui réduit significativement le VS entraîne une chute du DC. Des anomalies congénitales, telles qu’une sténose aortique ou pulmonaire, peuvent respectivement provoquer un obstacle marqué à l’éjection gauche ou droite, souvent accompagné d’une intolérance à l’effort et de syncopes. Cependant, la cause la plus courante d’obstacle à l’éjection chez le chat est liée à une obstruction dynamique de la chambre de chasse du ventricule gauche, secondaire à un mouvement systolique antérieur (MSA) de la valve mitrale. Ceci est fréquemment mis en évidence en cas de cardiomyopathie hypertrophique (CMH) 13. Cette anomalie peut cependant également être observée en l’absence d’hypertrophie ventriculaire gauche (HVG) 14. Une syncope secondaire à un MSA est pourtant rarement observée chez le chat, alors que chez l’Homme, des épisodes d’évanouissement sont fréquents lors de MSA sévère, avec ou sans HVG concomitante 15,16. La présence d’une obstruction dynamique de la chambre de chasse du ventricule droit (ODCCVD) est une autre découverte courante chez le chat, bien que cette anomalie semble être complètement bénigne dans cette espèce 17,18 et ne soit pas associée à des syncopes. Chez le chat, des syncopes secondaires à un obstacle à l’éjection ont également été observées en cas de dirofilariose cardiaque 9 ou de sténose aortique sévère (Figure 4).
 |
| a |
 |
| b |
 |
| c |
 |
| d |
 |
| e |
 |
| f |
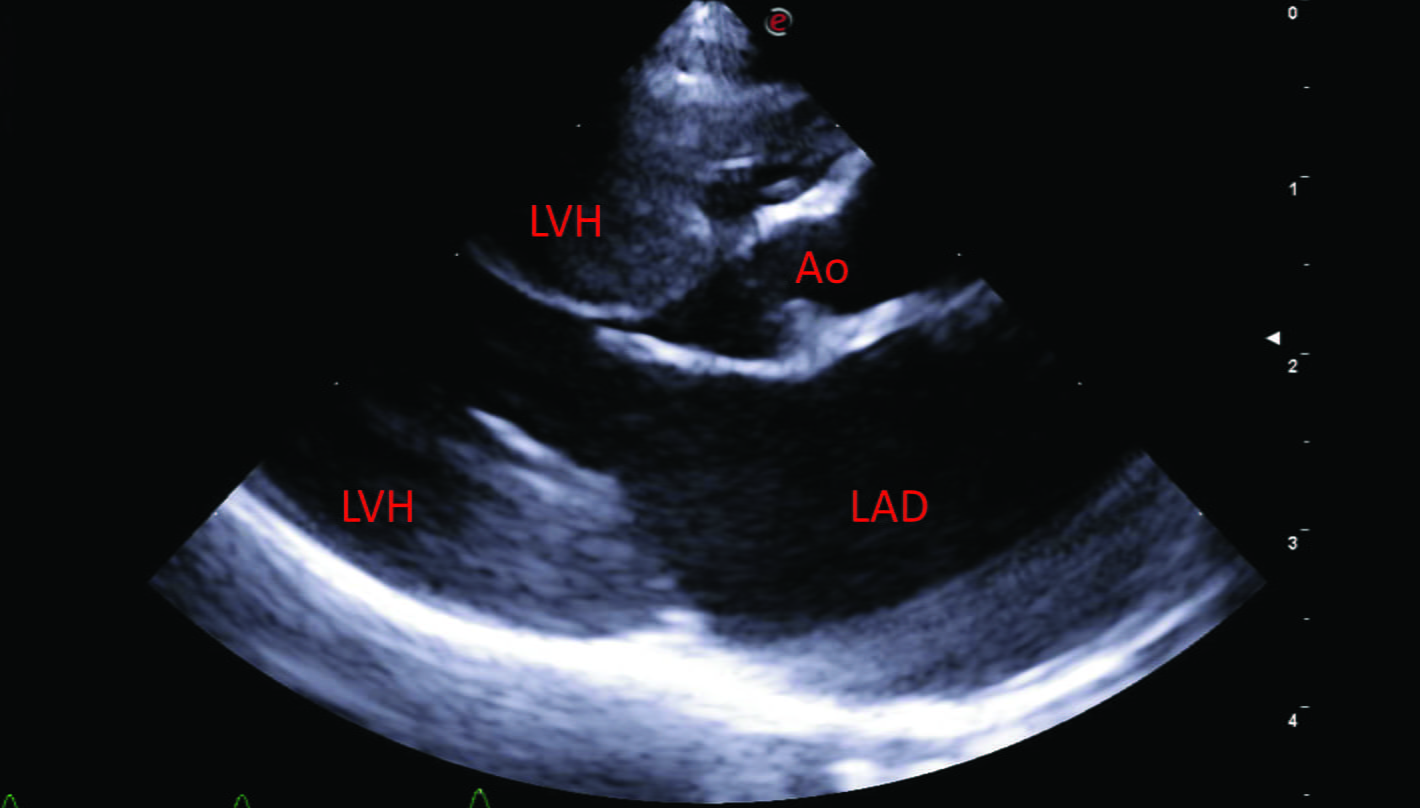
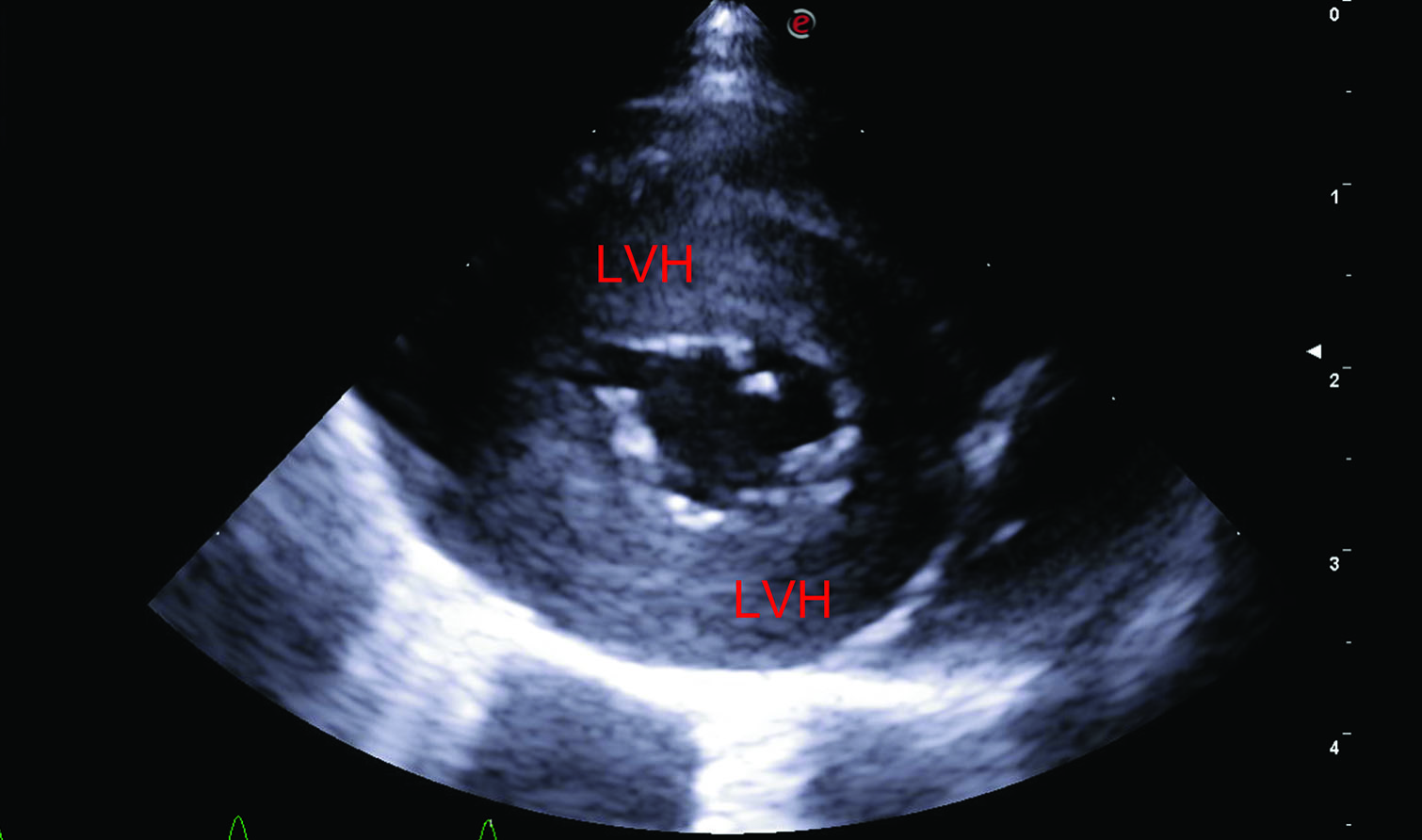
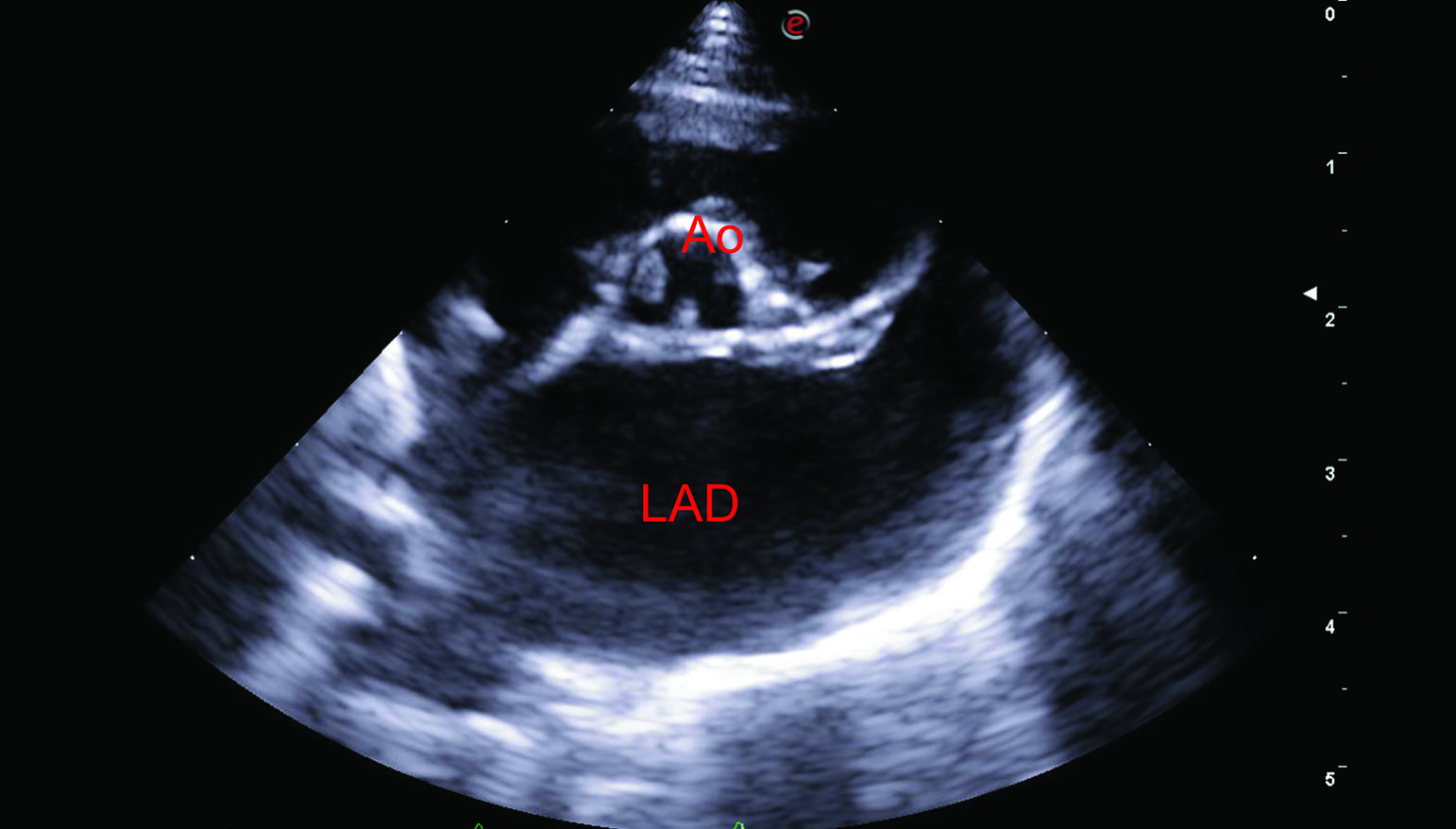
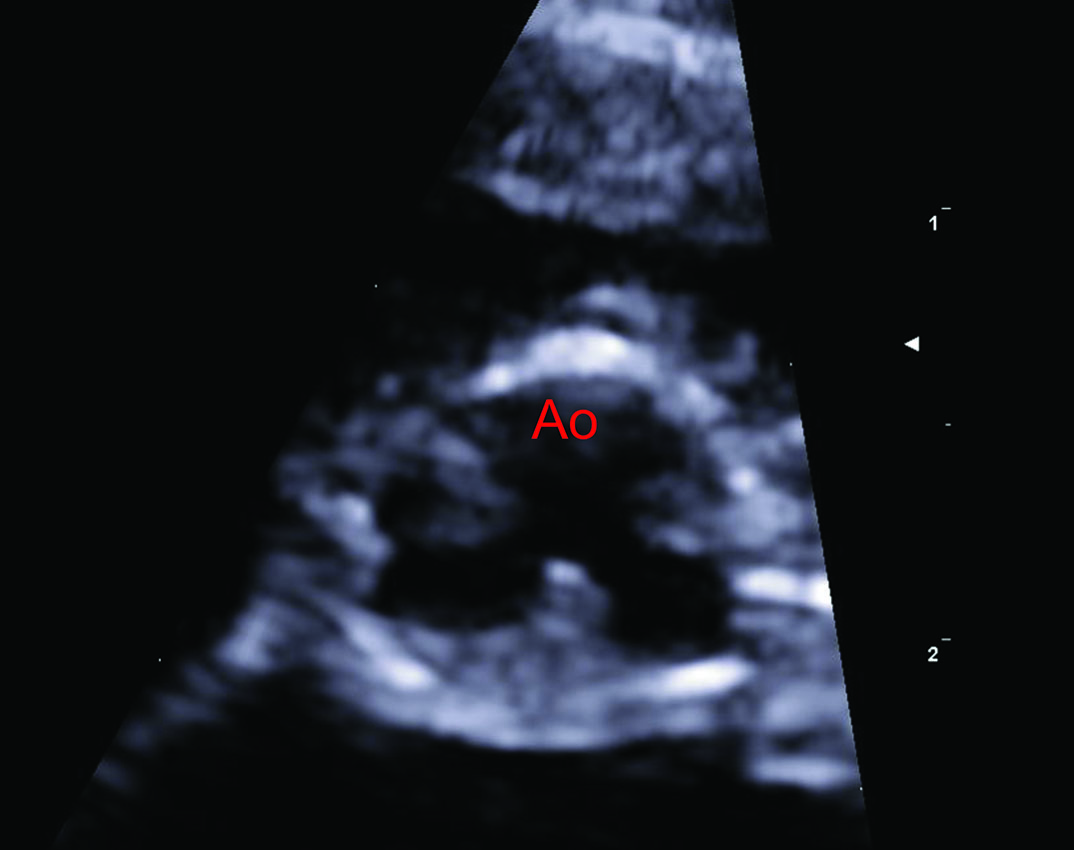
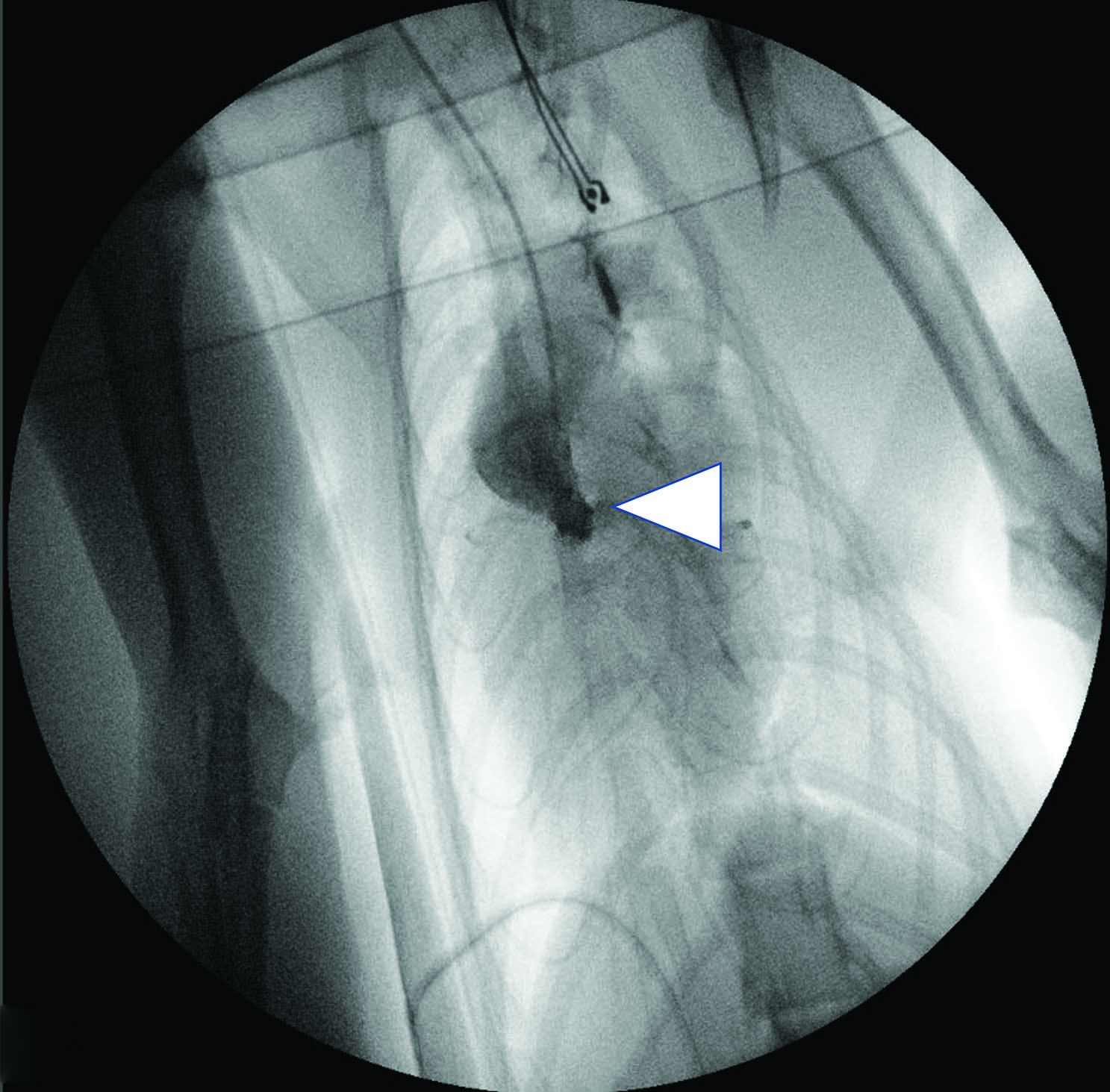
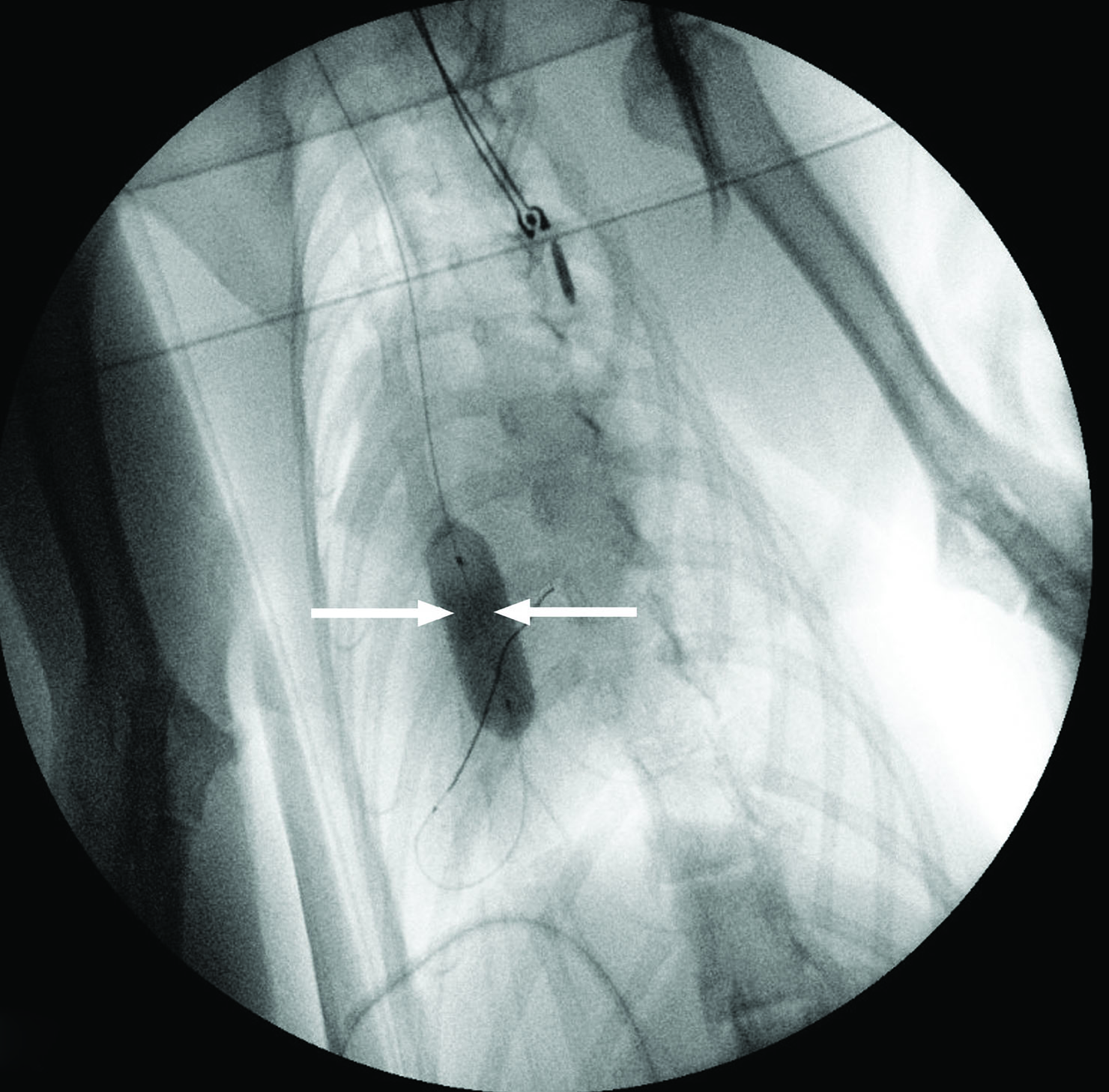
Figure 4. Chat Bengal femelle entier de 3 ans avec un historique de syncopes, suite à l’excitation pendant le jeu. Une forme sévère de sténose aortique valvulaire a été mise en évidence chez le chat (gradient de pression de 118 mmHg), à l’origine d’une hypertrophie concentrique du ventricule gauche et d’une insuffisance cardiaque congestive gauche. Les images échocardiographiques ont été obtenues sur des vues parasternales droites grand axe 5 cavités (a), petit axe transventriculaire (b), et petit axe transaortique (c et d) ; elles ont montré une importante hypertrophie concentrique du ventricule gauche (LVH), une dilatation de l’atrium gauche (LAD), ainsi que des cuspides valvulaires aortiques épaissies et partiellement fusionnées (Ao), responsables de la lésion sténotique. Les images (e) et (f) ont été obtenues sous guidage fluoroscopique pendant une valvuloplastie par ballonnet, pour diminuer l’importance de la sténose aortique. L’angiographie sélective permet de mettre la sténose en évidence (e, pointe de flèche blanche), tandis que le ballonnet complètement gonflé (f, flèches blanches) indique que la dilatation de la valve sténotique a réussi.
© Luca Ferasin
Des maladies du myocarde, telles que la CMH et la cardiomyopathie ventriculaire droite arythmogène (CVDA), peuvent provoquer une syncope d’origine cardiaque chez l’Homme et le chat 1,13,19. Bien que les arythmies cardiaques puissent jouer un rôle central dans l’apparition de syncope en cas de maladie myocardique, l’insuffisance myocardique doit également être prise en considération. Lors de CMH, par exemple, le DC peut être gravement affecté par la diminution du volume de remplissage du ventricule gauche et l’altération de la contractilité secondaire à l’hypertrophie myocardique, la désorganisation des fibres myocardiques, les remaniements cicatriciels myocardiques et la fibrose. Il en résulte une diminution du flux sanguin vers les vaisseaux coronaires intrapariétaux (et vers le reste du corps), à l’origine d’un infarctus intrapariétal du myocarde. Dans le cas de la CVDA, la présence de tissus fibro-graisseux dans le ventricule droit peut provoquer une dilatation du ventricule droit voire un anévrisme ventriculaire, entraînant un dysfonctionnement systolique important et une baisse conséquente du DC. De même, toutes les maladies cardiaques en phase terminale peuvent être accompagnées d’un dysfonctionnement du myocarde, d’une réduction de la contractilité cardiaque, et contribuer finalement à la baisse du DC.
Ce type de syncope est le plus courant chez l’Homme, chez qui il représente environ 45 % des cas 20, mais il est relativement rare chez le chat. La syncope peut être vasovagale, situationnelle ou secondaire à une hypersensibilité du sinus carotidien. La physiopathologie de la syncope à médiation nerveuse est assez complexe : elle est due à une augmentation du tonus sympathique, qui peut sensibiliser et faciliter l’activation des mécanorécepteurs cardiaques. Cela peut se produire lors d’une contraction ventriculaire très vigoureuse ou par l’activation des fibres C secondaire à l’ischémie myocardique et à la reperfusion. L’activation de ces récepteurs déclenche une réduction brutale de l’activité sympathique médiée par le système nerveux central, avec une activation parasympathique concomitante qui provoque une vasodilatation, une bradycardie, puis une hypotension rapide et profonde 21. Un exemple de syncope vasovagale chez un chat est illustré dans la Figure 5.
Une syncope situationnelle a été signalée chez un chat après défécation 10. Le mécanisme est probablement associé à l’augmentation de la pression intrathoracique et intra-abdominale pendant la défécation, qui tend à réduire le retour veineux, et à diminuer par conséquent la VS et le DC. Ce chat avait produit des efforts en déféquant avant la syncope, ce qui peut avoir activé les récepteurs intestinaux à la pression, entraînant une hypotension et une bradycardie soudaines. Chez l’Homme, une syncope situationnelle peut également être observée pendant ou immédiatement après la miction, la défécation, la toux ou la déglutition, selon un mécanisme similaire à celui expliqué ci-dessus.
 |
| a |
 |
| b |
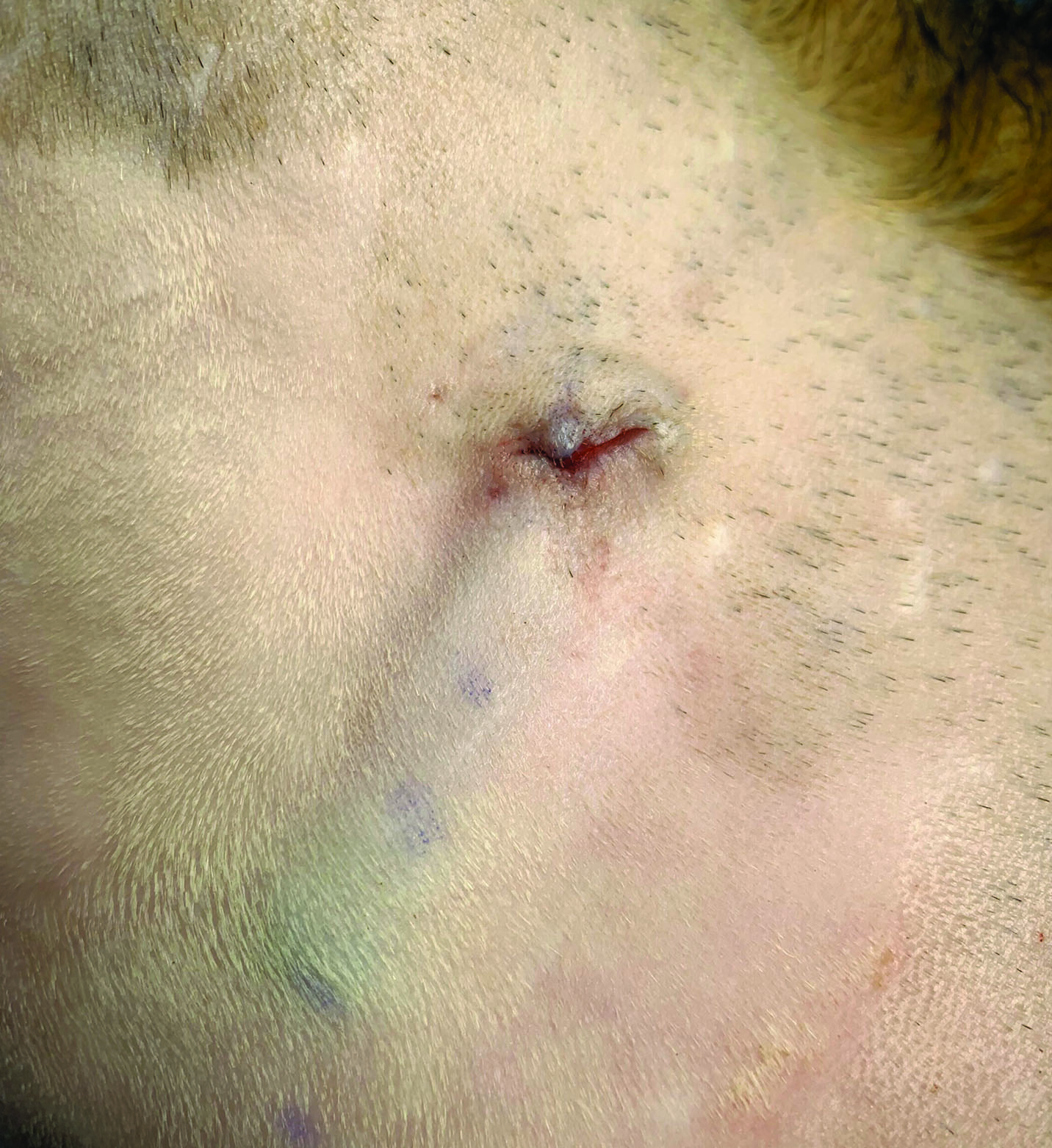
Figures 5a et b. Chat européen mâle castré de 5 ans présentant des syncopes après des périodes de stress ou d’excitation, comme des bagarres avec d’autres chats dans le jardin. Les épisodes survenaient toutes les 3 à 4 semaines environ, et le chat a été initialement référé pour une évaluation neurologique qui n’a rien révélé. Un bilan cardiologique a donc été demandé. L’échocardiographie n’a montré qu’une seule anomalie : une obstruction dynamique de la chambre de chasse du ventricule gauche (ODCCVG) significative, causée par le mouvement systolique antérieur (MSA) de la valve mitrale. Un enregistrement ECG standard a montré un rythme sinusal normal avec une fréquence cardiaque de 180 bpm, et l’enregistrement Holter de 24 heures n’a pas révélé d’anomalies ; le rythme sinusal était normal avec une fréquence quotidienne moyenne de 166 bpm (de 88 à 244 bpm). Aucune syncope n’est survenue pendant la période d’enregistrement. Un traitement empirique à l’aténolol (6,25 mg PO SID) n’a pas eu d’effet significatif, de sorte que la dose a été augmentée à 6,25 mg PO BID, mais cela a accru la fréquence des syncopes. Un enregistreur à boucle implantable (ILR) a donc été inséré chirurgicalement en sous-cutané, sur le côté gauche de la poitrine, pour surveiller l’ECG en permanence.
© Luca Ferasin

Figure 5c. La fonctionnalité du dispositif a été testée pendant l’intervention à l’aide d’un programmateur du pacemaker et d’un dispositif d’activation dédié au chat.
© Luca Ferasin

Figure 5d. L’analyse de l’ILR après un autre épisode de syncope a montré une période de tachycardie (à 300 bpm environ) pendant une bagarre entre chats, suivie d’une chute soudaine de la fréquence cardiaque à 100 bpm, au moment de la syncope. Les propriétaires ont vu ce qui se passait et ont immédiatement activé le dispositif. Pendant toute la durée de l’événement, l’ECG a pu être enregistré. Le tachogramme (série chronologique de l’intervalle RR) de l’ECG est compatible avec une syncope vasovagale (neurocardiogénique). Il a été conseillé aux propriétaires d’arrêter l’aténolol et d’éviter les événements stressants, comme les interactions avec d’autres chats, ce qui a permis la disparition complète des épisodes syncopaux.
© Luca Ferasin
L'aspect transitoire des syncopes et la résolution spontanée des signes cliniques font du diagnostic étiologique un véritable défi. Chez l’Homme, en l’absence d’anomalie signalée à l’anamnèse ou à l’examen physique, le diagnostic ne sera établi que dans 50 % des cas environ 22 et des chiffres similaires sont rapportés chez les animaux de compagnie. Une excellente compréhension de l’intérêt et de l’utilité des outils d’investigation est nécessaire pour permettre une prise en charge appropriée, rapide et efficace des cas de syncopes. En effet, la réalisation d’examens complémentaires dans un ordre inadapté présente un faible intérêt diagnostique et entraîne des coûts inutiles. De plus, un diagnostic tardif peut favoriser la mort subite 23. Il est fondamental de faire l’anamnèse du chat de manière approfondie et cohérente, et de poser les bonnes questions pour comprendre si le chat présente ou non des syncopes. En effet, l’entourage du chat décrit souvent de vagues épisodes d’affaissement et le vétérinaire doit donc déterminer si les événements rapportés sont accompagnés d’une perte de connaissance transitoire. Les syncopes se caractérisent par un début rapide, une courte durée (généralement pas plus de 20 secondes), et sont suivies d’une récupération spontanée et complète, bien qu’une désorientation transitoire puisse être observée pendant plusieurs minutes dans certains cas. Les propriétaires seront aussi interrogés en détail à propos des antécédents de maladie cardiaque, des médicaments administrés pouvant induire des arythmies ou une hypotension, du nombre et de la fréquence des syncopes (avec une description la plus détaillée possible), des facteurs favorisants ou déclenchants, en précisant l’activité physique du chat, l’heure de la journée, les conditions environnementales, le degré d’excitation, etc. avant ou pendant la syncope. Il est important de quantifier avec précision le type et la durée de l’événement, et d’obtenir des informations (si possible) sur la couleur des muqueuses et le rythme cardiaque pendant les syncopes. Une cause neurologique sera plus probable en cas de léthargie, de désorientation ou de changements de comportement après la chute (gueule écumante, phase inconsciente pendant plus de quelques minutes) et que les muqueuses ne sont ni pâles ni cyanosées. Néanmoins, certains chats présentent des épisodes de syncope prolongés et perdent le contrôle sphinctérien, entraînant des défécations ou des mictions involontaires ; ils peuvent aussi manifester une activité tonico-clonique et un opisthotonos, comme lors d’une crise d’épilepsie 24. C’est pourquoi de nombreux chats sujets à des syncopes sont considérés à tort comme épileptiques, et des examens diagnostiques coûteux et souvent inutiles sont souvent mis en œuvre, impliquant parfois une anesthésie générale. Il est donc très important d’analyser ce qui se passe avant, pendant et après la chute pour distinguer, autant que possible, ces deux présentations similaires. Dans de tels cas, il est très utile que le propriétaire tienne un journal détaillé des syncopes et enregistre les épisodes en vidéo, avec son téléphone, par exemple.
Un examen clinique complet, incluant une évaluation soigneuse des systèmes neurologique et cardio-vasculaire, est probablement la composante la plus importante de l’évaluation d’un chat présentant des syncopes 25. L’examen sera effectué de manière approfondie et cohérente, en accordant une attention particulière aux paramètres cardio-vasculaires (comme la mesure de la pression artérielle), au niveau d’hydratation et à la présence d’anomalies neurologiques ou musculosquelettiques concomitantes. Une arythmie cardiaque, un souffle ou un bruit de galop évoquent fortement une anomalie cardiaque sous-jacente et justifient de pousser plus loin l’exploration cardiaque.
Les analyses de laboratoire (bilans hématologique et biochimique de base) ont un faible intérêt diagnostique mais elles sont nécessaires pour exclure une anémie grave, une déshydratation, des déséquilibres électrolytiques et des lésions musculosquelettiques. Une élévation du niveau de la troponine cardiaque I peut être le signe d’une atteinte myocardique sous-jacente, incluant l’ischémie et la myocardite. Un niveau élevé de thyroxine (T4) évoquera une hyperthyroïdie, qui peut avoir des effets délétères sur le cœur.
L’échocardiographie sera envisagée si l’examen clinique révèle des anomalies cardiaques ou si une maladie cardiaque figure dans les antécédents familiaux ou dans les prédispositions individuelles. Chez la majorité des chats présentant des syncopes, les résultats échocardiographiques ne montrent rien d’anormal. L’électrocardiographie (ECG) au repos ne permet d’identifier la cause des syncopes que chez un faible pourcentage de chats. Des syncopes épisodiques peuvent cependant être la conséquence d’un trouble intermittent sous-jacent qui passe souvent inaperçu à l’ECG, même sur un enregistrement continu de cinq minutes. Une surveillance ECG prolongée est alors plus susceptible d’aider au diagnostic. Néanmoins, même un enregistrement Holter de 24 à 48 heures a une valeur diagnostique relativement faible, surtout lorsque les syncopes sont occasionnelles, et l’enregistrement peut donc ne rien montrer. Une surveillance Holter ne se justifie que si les syncopes surviennent plusieurs fois par semaine 19. Une surveillance de 7 à 14 jours, qui n’est possible qu’avec un nombre limité d’appareils, améliore néanmoins la probabilité d’aboutir à un diagnostic concluant 25. L’intérêt diagnostique augmente considérablement si un enregistreur à boucle implantable (implantable loop recorder ou ILR) est utilisé. La littérature vétérinaire confirme que la fiabilité et la précision des résultats obtenus avec un ILR est excellente 7,23. Chez les chats présentant des syncopes d’origine indéterminée, l’activation manuelle de l’ILR peut donner des informations diagnostiques et pronostiques précieuses, en confirmant ou en infirmant l’association entre la syncope et les arythmies ou les anomalies de conduction. Si une syncope est observée et que les examens présentés ici (y compris l’ILR) ne sont pas concluants ou n’évoquent pas une étiologie cardiaque, d’autres approches doivent être envisagées, en utilisant l’échographie abdominale (pour exclure une hémorragie interne), des moyens d’imagerie avancée (IRM, scanner), l’électromyographie, l’électroencéphalographie et un prélèvement de liquide céphalo-rachidien (LCR).
Luca Ferasin
Le traitement d’un chat à syncope a trois objectifs principaux : éviter la mort subite et prolonger la survie, éviter les traumatismes lors des syncopes et prévenir la survenue d’autres syncopes. L’approche thérapeutique dépend largement de la cause et du mécanisme de la syncope. Si un diagnostic définitif n’a pas pu être établi, il faut demander aux propriétaires de garder leur chat à l’intérieur afin d’éviter les accidents pouvant survenir si l’animal est laissé sans surveillance. En revanche, si un diagnostic a été réalisé, le traitement visera à contrôler l’affection primaire sous-jacente responsable de la perte de conscience transitoire. Par exemple, le traitement d’une tachycardie soutenue, voire paroxystique, d’origine ventriculaire ou supraventriculaire requerra des médicaments antiarythmiques tels que l’aténolol et le sotalol par voie orale. Le diltiazem est sans effet sur les arythmies ventriculaires mais peut être envisagé pour les arythmies supraventriculaires. Cependant, tous ces médicaments peuvent également diminuer de manière significative la FC au repos et affecter le VS et le DC, accélérant potentiellement le développement d’une insuffisance cardiaque congestive (ICC) chez les chats présentant des troubles myocardiques sous-jacents. Il est donc prudent de prévoir un enregistrement Holter de 24 heures quelques jours après le début du traitement antiarythmique pour surveiller la réponse appropriée au traitement et la présence résiduelle éventuelle d’épisodes de tachycardie paroxystique.
Pour les chats présentant une syncope associée à une bradycardie, le traitement approprié repose en général sur l’implantation d’un stimulateur cardiaque (pacemaker) permanent. Chez le chien, l’implantation d’un pacemaker se fait habituellement en plaçant une sonde de stimulation transveineuse dans l’apex ventriculaire droit. Cependant, cette technique entraîne souvent des complications chez le chat, telles que le syndrome de la veine cave crâniale avec chylothorax, un obstacle à l’éjection ventriculaire droite et une thrombose intracardiaque 4,26. Par conséquent, l’implantation d’un pacemaker chez le chat passera plutôt par la pose chirurgicale d’une sonde épicardique par thoracotomie ; cette technique présente un bon taux de réussite et n’entraîne généralement que des complications mineures.
Les obstacles fixes à l’origine d’une obstruction à l’éjection ventriculaire, telles que les sténoses aortiques et pulmonaires, peuvent être levés grâce à une valvuloplastie par ballonnet, une intervention peu invasive : le ballonnet présent à l’extrémité du cathéter sera gonflé au niveau de la valve sténotique pour dilater et ouvrir les cuspides partiellement fusionnées. Les obstructions dynamiques entraînent très rarement des syncopes chez le chat mais, si une relation de cause à effet est mise en évidence, un traitement avec des bêtabloquants (par exemple, l’aténolol) sera tenté pour réduire l’ampleur de l’obstruction.
Il est rarement nécessaire de traiter les syncopes à médiation nerveuse. Une anamnèse minutieuse axée sur l’identification des facteurs favorisants devrait révéler les événements déclencheurs (par exemple, le stress, l’excitation) et la prévention de ces circonstances suffit en général pour réduire considérablement la fréquence et la gravité des syncopes. Les syncopes situationnelles peuvent être contrôlées avec succès en traitant, et en éliminant si possible, le phénomène sous-jacent (par exemple, la toux ou l’effort pendant la miction et la défécation). L’implantation d’un pacemaker est une solution controversée pour les syncopes à médiation nerveuse mais elle peut être envisagée si la syncope est provoquée par des pauses cardiaques très longues. Dans ce cas, le principal problème est que le pacemaker ne peut pas contrôler l’hypotension systémique associée à la vasodilatation vagale secondaire soudaine. Il doit donc être programmé avec un algorithme de stimulation spécialisé, comme l’algorithme d’hystérésis de fréquence. Le pacemaker ne commencera alors à stimuler le ventricule que si la fréquence cardiaque spontanée tombe en dessous d’un niveau critique, et la stimulation continuera au rythme plus élevé sélectionné, sauf si une activité ventriculaire intrinsèque est détectée. L’objectif est que, lorsqu’un événement se produit, l’hypotension provoquée par la réduction soudaine de la RPT soit compensée par le rythme plus élevé de la stimulation artificielle.
Lorsqu’un chat présente des syncopes, le diagnostic peut être délicat, et il est essentiel de procéder avec beaucoup de logique lors de l’anamnèse, de l’examen clinique et des examens complémentaires. Un trouble cardiaque primaire est présent chez la majorité des chats présentant des syncopes mais il existe aussi d’autres causes. Le traitement doit viser à prolonger la survie en évitant la mort subite, à éviter les blessures dues aux chutes et à prévenir des syncopes ultérieures, mais l’approche thérapeutique dépend de la cause et du mécanisme de la syncope. Il est cependant essentiel de ne pas confondre syncope et crise d’épilepsie, une affection qui nécessite une approche complètement différente et dont le pronostic peut être différent.
Remerciements
L’auteur remercie la Dre Heidi Ferasin pour son aide dans la gestion de certains des cas cliniques présentés et pour son aide précieuse dans la rédaction de cet article. Un remerciement particulier est également adressé à la Dre Daniella McCready, qui a procédé à l’implantation chirurgicale du pacemaker décrit dans la Figure 3.
Payne JR, Borgeat K, Brodbelt DC, et al. Risk factors associated with sudden death vs. congestive heart failure or arterial thromboembolism in cats with hypertrophic cardiomyopathy. J. Vet. Cardiol. 2015;17 Suppl 1:S318-328. DOI: 10.1016/j.jvc.2015.09.008. PubMed PMID: 26776589.
Brignole M. Distinguishing syncopal from non-syncopal causes of fall in older people. Age Ageing 2006;35 Suppl 2:ii46-ii50. DOI: 10.1093/ageing/afl086. PubMed PMID: 16926204.
Meurs KM, Miller MW, Mackie JR, et al. Syncope associated with cardiac lymphoma in a cat. J. Am. Anim. Hosp. Assoc. 1994;30:583-585.
Ferasin L, van de Stad M, Rudorf H, et al. Syncope associated with paroxysmal atrioventricular block and ventricular standstill in a cat. J. Small Anim. Pract. 2002;43(3):124-128. DOI: 10.1111/j.1748-5827.2002.tb00042.x. PubMed PMID: 11916056.
Harvey AM, Battersby IA, Faena M, et al. Arrhythmogenic right ventricular cardiomyopathy in two cats. J. Small Anim. Pract. 2005;46(3):151-156. DOI: 10.1111/j.1748-5827.2005.tb00306.x. PubMed PMID: 15789811.
Lee S, Kittleson MD. Naturally occurring torsades de pointes and QT interval prolongation in a domestic cat. J. Vet. Cardiol. 2021;35:42-47. Epub 20210303. DOI: 10.1016/j.jvc.2021.02.006. PubMed PMID: 33812132.
Ferasin L. Recurrent syncope associated with paroxysmal supraventricular tachycardia in a Devon Rex cat diagnosed by implantable loop recorder. J. Feline Med. Surg. 2009;11(2):149-152. Epub 20080703. DOI: 10.1016/j.jfms.2008.04.006. PubMed PMID: 18602324.
Harwood ML. Paroxysmal atrial tachycardia and left superior bundle branch blockage in a cat. Vet. Med. Small Anim. Clin. 1970;65(9):862-866. PubMed PMID: 5201514.
Malik R, Church DB, Eade IG. Syncope in a cat. Aust. Vet. J. 1998;76(7):465, 70-71. DOI: 10.1111/j.1751-0813.1998.tb10180.x. PubMed PMID: 9700397.
Whitley NT, Stepien RL. Defaecation syncope and pulmonary thromboembolism in a cat. Aust. Vet. J. 2001;79(6):403-405. DOI: 10.1111/j.1751-0813.2001.tb12982.x. PubMed PMID: 11491217.
Gouni V, Papageorgiou S, Debeaupuits J, et al. Aortic dissecting aneurysm associated with systemic arterial hypertension in a cat. Schweiz Arch. Tierheilkd. 2018;160(5):320-324. DOI: 10.17236/sat00162. PubMed PMID: 29717986.
Hsueh T, Yang CC, Lin SL, et al. Symptomatic partial anomalous pulmonary venous connection in a kitten. J. Vet. Intern. Med. 2020;34(6):2677-2681. Epub 20201016. DOI: 10.1111/jvim.15934. PubMed PMID: 33063892; PubMed Central PMCID: PMC7694797.
Ferasin L. Feline myocardial disease. 1: Classification, pathophysiology and clinical presentation. J. Feline Med. Surg. 2009;11(1):3-13. DOI: 10.1016/j.jfms.2008.11.008. PubMed PMID: 19154970.
Ferasin L, Kilkenny E, Ferasin H. Evaluation of N-terminal prohormone of brain natriuretic peptide and cardiac troponin-I levels in cats with systolic anterior motion of the mitral valve in the absence of left ventricular hypertrophy. J. Vet. Cardiol. 2020;30:23-31. Epub 20200518. DOI: 10.1016/j.jvc.2020.05.001. PubMed PMID: 32645686.
Hodges K, Rivas CG, Aguilera J, et al. Surgical management of left ventricular outflow tract obstruction in a specialized hypertrophic obstructive cardiomyopathy center. J. Thorac. Cardiovasc. Surg. 2019;157(6):2289-2299. Epub 20181229. DOI: 10.1016/j.jtcvs.2018.11.148. PubMed PMID: 30782406.
Sabzwari SRA, Kimber JR, Ayele H, et al. The disappearing murmur: systolic anterior motion of the mitral valve leaflet in a non-hypertrophic cardiomyopathy patient. Cureus. 2018;10(6):e2855. Epub 20180621. DOI: 10.7759/cureus.2855. PubMed PMID: 30148008; PubMed Central PMCID: PMC6104906.
Ferasin L, Ferasin H, Kilkenny E. Heart murmurs in apparently healthy cats caused by iatrogenic dynamic right ventricular outflow tract obstruction. J. Vet. Intern. Med. 2020;34(3):1102-1107. Epub 20200428. DOI: 10.1111/jvim.15774. PubMed PMID: 32343450; PubMed Central PMCID: PMC7255668.
Rishniw M, Thomas WP. Dynamic right ventricular outflow obstruction: a new cause of systolic murmurs in cats. J. Vet. Intern. Med. 2002;16(5):547-552. DOI: 10.1892/0891-6640(2002)016<0547:drvooa>2.3.co;2. PubMed PMID: 12322704.
Ferasin L, Ferasin H, Borgeat K. Twenty-four-hour ambulatory (Holter) electrocardiographic findings in 13 cats with non-hypertrophic cardiomyopathy. Vet. J. 2020;264:105537. Epub 20200906. DOI: 10.1016/j.tvjl.2020.105537. PubMed PMID: 33012440.
Runser LA, Gauer RL, Houser A. Syncope: evaluation and differential diagnosis. Am. Fam. Physician 2017;95(5):303-312. PubMed PMID: 28290647.
Grubb BP. Pathophysiology and differential diagnosis of neurocardiogenic syncope. Am. J. Cardiol. 1999;84(8A):3Q-9Q. DOI: 10.1016/s0002-9149(99)00691-8. PubMed PMID: 10568555.
Gould PA, Krahn AD, Klein GJ, et al. Investigating syncope: a review. Curr. Opin. Cardiol. 2006;21(1):34-41. DOI: 10.1097/01.hco.0000198986.16626.86. PubMed PMID: 16355027.
Willis R, McLeod K, Cusack J, et al. Use of an implantable loop recorder to investigate syncope in a cat. J. Small Anim. Pract. 2003;44(4):181-183. DOI: 10.1111/j.1748-5827.2003.tb00142.x. PubMed PMID: 12703871.
Schriefl S, Steinberg TA, Matiasek K, et al. Etiologic classification of seizures, signalment, clinical signs, and outcome in cats with seizure disorders: 91 cases (2000-2004). J. Am. Vet. Med. Assoc. 2008;233(10):1591-1597. DOI: 10.2460/javma.233.10.1591. PubMed PMID: 19014293.
Bright JM, Cali JV. Clinical usefulness of cardiac event recording in dogs and cats examined because of syncope, episodic collapse, or intermittent weakness: 60 cases (1997-1999). J. Am. Vet. Med. Assoc. 2000;216(7):1110-1114. DOI: 10.2460/javma.2000.216.1110. PubMed PMID: 10754673.
Frantz EW, Tjostheim SS, Palumbo A, et al. A retrospective evaluation of the indications, complications, and outcomes associated with epicardial pacemakers in 20 cats from a single institution. J. Vet. Cardiol. 2021;36:89-98. Epub 20210513. DOI: 10.1016/j.jvc.2021.05.001. PubMed PMID: 34118563.
Luca Ferasin
Le Dr Ferasin est diplômé (avec mention) de l’Université de Bologne depuis 1992. Il a fait trois ans de recherches en endocrinologie à l’institut BBSRC de Cambridge et a obtenu son PhD en 1996. En savoir plus
Cet article montre que les nématodes pulmonaires et cardiaques sont sous-estimés alors que ces parasites représentent une grave menace pour de nombreux chats.
La hernie diaphragmatique est une conséquence fréquente des traumatismes chez les chats. Elle peut être fatale si elle n’est pas rapidement diagnostiquée et traitée. Cet article passe en revue la physiopathologie et le traitement de cette affection.
Le chylothorax est à inclure dans le diagnostic différentiel chez tout chat présentant un épanchement pleural. Elizabeth Rozanski décrit ici l’approche qu’elle privilégie dans de tels cas.
L’asthme est une maladie fréquente chez le chat mais qui peut ressembler à de nombreuses autres maladies. Cet article montre à quel point le diagnostic et le traitement de cette affection peuvent être délicats.
