Internship veterinari negli USA
State pensando di svolgere un internship negli USA? Questo articolo fornisce una breve guida ai vantaggi e svantaggi, come pure indicazioni su ciò che può essere offerto.
Pubblicato il 29/03/2023
Disponibile anche in Français , Deutsch , Português , Español e English
L’insufficienza cardiaca acuta nei cani è associata a un grave rischio di morte, ed è quindi fondamentale ottimizzare la diagnosi e il trattamento, come discusso da Luca Ferasin.

Il segno cardinale dell’insufficienza cardiaca acuta nei cani è la tachipnea e/o la dispnea, sebbene possano essere anche presenti varie altre anomalie.
Ogni volta che un cane arriva alla presentazione con insufficienza cardiaca acuta sospetta vanno considerate tre misure immediate, cioè minimizzazione dello stress, integrazione con ossigeno, e sedazione.
Una terapia diuretica appropriata fornisce in genere un sollievo rapido e completo dagli effetti dell’edema polmonare, e va quindi proseguita per evitare recidive.
La frequenza respiratoria, lo sforzo respiratorio e la vitalità generale sono i parametri più importanti da monitorare quando si tratta un cane con insufficienza cardiaca acuta.
L’insufficienza cardiaca (HF) è una delle cause più comuni di morbilità e mortalità nei cani e, come presentazione acuta (insufficienza cardiaca acuta; AHF), rappresenta un rischio grave di morte, cosa che richiede il ricovero in un reparto di terapia intensiva. Esistono molte definizioni di HF, ma andrebbe considerata in definitiva una sindrome clinica complessa che può derivare da qualsiasi disturbo cardiaco strutturale o funzionale tale da compromettere la capacità del cuore di riempirsi di sangue o di pomparlo fuori, con la conseguente incapacità di soddisfare il fabbisogno metabolico dei tessuti corporei 1. I segni clinici associati all’AHF dipendono principalmente dalla cardiopatia sottostante, che può interessare l’endocardio (cioè, valvulopatia), il miocardio (cioè, cardiomiopatie) o i grossi vasi (ad es. ipertensione polmonare o sistemica, embolia arteriosa). I cani con AHF presentano di solito segni clinici relativi a un’insufficienza cardiaca sinistra, precisamente a livello del ventricolo sinistro e dell’atrio sinistro, ma è anche relativamente comune l’insufficienza cardiaca destra o quella biventricolare. Nella maggior parte dei cani con cardiopatia coesistono anomalie della disfunzione sistolica e diastolica, e quindi la differenziazione tradizionale tra insufficienza sistolica e diastolica non ha alcuna importanza clinica reale.
Le manifestazioni più eminenti dell’AHF sono la tachipnea e/o la dispnea, sebbene i cani con HF destra possano presentare principalmente una dilatazione addominale secondaria all’ascite. Segni meno specifici possono includere letargia, disturbi relativi alle capacità fisiche, inappetenza, ansia, e ipotermia, sebbene l’intolleranza all’esercizio fisico passi spesso inosservata nelle razze di taglia piccola/toy dato il loro stile di vita sedentario. La tachipnea/dispnea è principalmente conseguenza della ritenzione di fluidi (insufficienza cardiaca congestizia o CHF) ed è caratterizzata da edema polmonare e/o versamento pleurico e/o ascite, sebbene l’ascite debba essere particolarmente grave per causare anomalie respiratorie. Pertanto, i termini insufficienza cardiaca (HF) e insufficienza cardiaca congestizia (CHF) vengono spesso usati in modo intercambiabile in cardiologia canina.
Circa il 50% dei cani con valvulopatia mitralica ha la tosse, spesso indicata come “tosse cardiaca”, il cui meccanismo viene spesso spiegato in modi diversi. La spiegazione errata più comune è la presenza di edema polmonare, come spesso riportato nei libri di testo, e storicamente rafforzato in modo inappropriato nella formazione veterinaria. Tuttavia, il riflesso della tosse non può essere evocato nelle vie respiratorie più profonde (bronchioli respiratori o spazio alveolare) dove si forma l’edema polmonare, poiché a questo livello non sono presenti recettori della tosse. Al contrario, la presenza di fluido in queste aree causa quasi inevitabilmente tachipnea e/o dispnea. Un’altra spiegazione è lo stimolo meccanico dei recettori della tosse bronchiale causato dalla dilatazione cardiaca (e in particolare da quella dell’atrio sinistro, che si trova appena sotto i bronchi principali). Tuttavia, i cuccioli con difetti cardiaci congeniti significativi e cardiomegalia grave hanno raramente tosse alla presentazione. Dato che la malattia delle vie aeree viene osservata più spesso nei cani anziani, rispetto ai soggetti giovani che hanno un apparato respiratorio sano, la cardiomegalia può essere una causa più probabile di tosse nei pazienti con malattia delle vie aeree preesistente, data la stimolazione cumulativa dei recettori della tosse causata dalle due comorbilità. In effetti, la dilatazione atriale sinistra è associata a un rischio aumentato di tosse nei cani con valvulopatia mitralica degenerativa cronica, e in caso di coesistenza di dilatazione atriale sinistra e malattia delle vie aeree il rischio di tosse è dieci volte maggiore, anche in assenza dell’edema polmonare. Pertanto, il termine “tosse cardiaca” va considerato un termine improprio, poiché la tosse ha origine dalle vie aeree, anche nei pazienti cardiopatici. L’unica eccezione potrebbe essere una tosse secondaria a edema polmonare fulminante nella CHF iperacuta, osservata principalmente nelle razze di taglia maggiore, a causa dell’allagamento delle vie aeree e conseguente stimolazione dei recettori della tosse. Tuttavia, anche in questo caso, i segni clinici principali sono rappresentati da tachipnea/dispnea, e quindi una tosse senza tachipnea/dispnea non può essere indicativa di CHF. Per questo motivo, nei pazienti cardiopatici con tosse alla presentazione, la diagnosi differenziale deve sempre includere altre comorbilità, come ad esempio tracheobronchite infettiva, collasso tracheale, broncomalacia, malattia da reflusso gastroesofageo (GERD), sindrome da gocciolamento retronasale (PNDS), neoplasia, o broncopolmonite 2,3.
I riscontri dell’esame obiettivo che possono confermare la presenza di HF in un cane con tachipnea/dispnea a esordio acuto includono il rilevamento di un soffio cardiaco all’auscultazione (di solito forte, anche se può essere più debole nelle razze di taglia grande), pallore delle mucose, cianosi, polsi femorali deboli, tachicardia, aritmie, e ipotermia. I soffi cardiaci sono certamente un riscontro importante per identificare un’anomalia cardiaca sottostante che potrebbe aver determinato l’esordio dell’AHF. I soffi forti nei cani di razza piccola con valvulopatia mitralica mixomatosa (MMVD) non sono necessariamente la prova che esiste una malattia abbastanza grave da causare AHF, ma la probabilità di rimodellamento cardiaco avanzato associato all’HF aumenta all’aumentare dell’intensità del soffio. Al contrario, in questi cani, i soffi deboli sono fortemente indicativi di malattia lieve 4. Tuttavia, nei cani di taglia grande e gigante, non si rileva necessariamente un soffio cardiaco forte in presenza di cardiopatia grave associata a rigurgito valvolare, stenosi valvolare, e persino nello shunt. Il motivo di questi soffi “silenziosi” nelle razze di taglia grande non è del tutto chiaro, ma potrebbe essere dovuto alle dimensioni e alla conformazione del torace, con conseguente attenuazione dei suoni che viaggiano dall’origine della turbolenza del flusso ematico alla superficie del torace. Inoltre, questi cani spesso ansimano senza sosta durante l’esame obiettivo, complicando l’auscultazione cardiaca.
Sebbene i crepitii siano stati storicamente segnalati come indicativi di edema polmonare alveolare, tale affermazione non è del tutto corretta. Sono per lo più generati dalla chiusura improvvisa delle vie aeree durante l’espirazione e dalla riapertura improvvisa delle stesse vie durante l’inspirazione, una condizione che è più comune nella polmonite, nella malattia polmonare interstiziale, e in altri disturbi del parenchima. Inoltre, i ronchi associati alla malattia bronchiale vengono spesso erroneamente descritti come crepitii, con conseguente rischio di emettere una diagnosi errata 5.
Oggi, la percussione toracica viene eseguita raramente nella pratica dei piccoli animali data l’ampia disponibilità dell’ecografia point-of-care (POCUS), ma questa semplice valutazione è sempre raccomandata per identificare la linea orizzontale di ottusità associata al versamento pleurico.
Un altro importante riscontro fisico da considerare prima di emettere una diagnosi di AHF è la presenza o l’assenza di aritmia sinusale. Si tratta di una variazione fisiologica della frequenza cardiaca (FC), solitamente associata al ciclo respiratorio (cioè, FC aumentata durante l’inspirazione e FC ridotta durante l’espirazione), che tende a scomparire nell’HF a causa dell’aumento del tono simpatico e della concomitante assenza del tono (vagale) parasimpatico 6. Pertanto, la presenza di aritmia sinusale in un cane con tachipnea/dispnea a esordio acuto rende generalmente molto improbabile la diagnosi di AHF.
Sulla base delle considerazioni di cui sopra, la diagnosi di AHF non è sempre semplice e dovrebbe basarsi su vari fattori, tra cui un esordio acuto di tachipnea/dispnea, riscontri specifici all’esame obiettivo (ad es. soffio cardiaco, aritmia o toni di galoppo) e riconoscimento di edema polmonare, versamento pleurico e ascite alla radiografia e/o ecografia. I biomarcatori cardiaci possono essere utili per rilevare il danno miocardico (cioè, troponina I cardiaca) o lo stiramento del miocardio (NT-proBNP), sebbene non possano fornire una conferma definitiva di CHF se non valutati insieme all’intero quadro clinico. Pertanto, non esiste un unico test diagnostico per l’AHF e la sua diagnosi rimane in gran parte un giudizio clinico basato su un’accurata raccolta dell’anamnesi e una visita clinica approfondita 1.
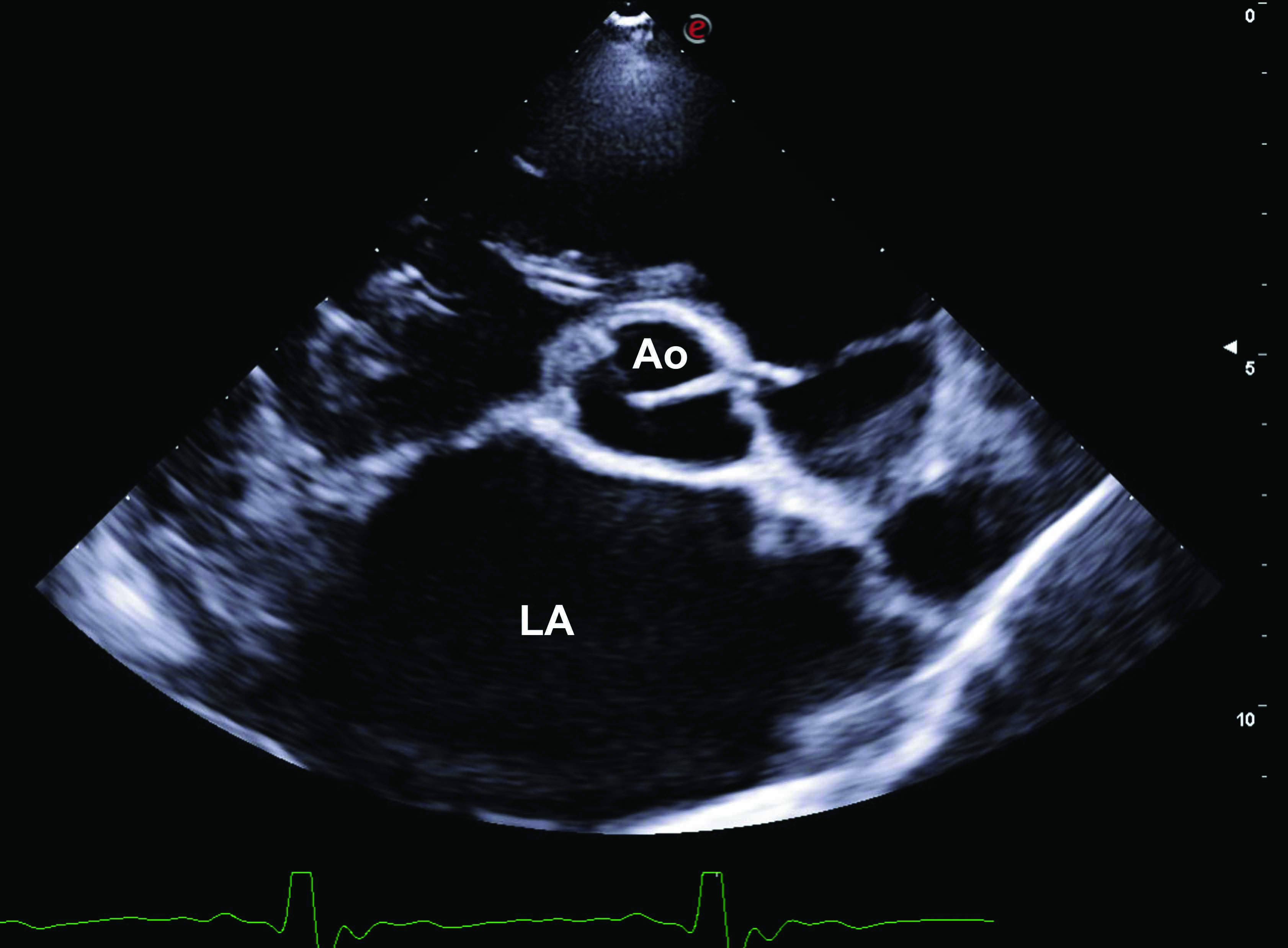
I cani che con segni acuti di CHF sono vulnerabili, e qualsiasi ulteriore fattore di stress o ansia può aggravare potenzialmente i segni respiratori; per questo è consigliabile sedare questi pazienti prima di tentare qualsiasi test diagnostico o procedura terapeutica. Questo rende il cane più tranquillo e collaborante, e può ridurre i fabbisogni metabolici periferici che non possono essere altrimenti soddisfatti dalla gittata cardiaca ridotta che accompagna tutti i casi di AHF. Il cane deve essere mantenuto in un comodo decubito sternale per facilitare i movimenti respiratori naturali. Se si rileva un’ottusità alla percussione toracica, ciò dovrebbe far sorgere il sospetto di versamento pleurico, che può essere facilmente confermato se sono disponibili attrezzature e competenze ecografiche. Prima della radiografia toracica, è possibile eseguire un esame con ecografia point-of-care (POCUS) rapido che consente di identificare i segni della cardiopatia sottostante significativa, come ad esempio dilatazione atriale sinistra, disfunzione sistolica, ascite, versamento pleurico e pericardico 7. Idealmente, la POCUS andrebbe eseguita con il cane in piedi o in decubito sternale, dopo sedazione e contemporanea integrazione con ossigeno. Imparare a eseguire l’ecografia toracica è relativamente semplice e intuitivo, e i medici veterinari non specializzati possono acquisire le necessarie competenze per identificare condizioni come dilatazione atriale sinistra, versamenti pleurici e versamenti pericardici 8. Le dimensioni dell’atrio sinistro (LA), misurate in modalità B dalla vista sull’asse lungo a quattro camere parasternale destra, sono facili da ottenere anche per medici veterinari non formati. Una dimensione del LA indicizzata sul diametro aortico (LA/Ao) superiore a 1,6 nella vista sull’asse corto parasternale destra alla base del cuore suggerisce una dilatazione atriale sinistra; tuttavia, nei cani con AHF, l’indice LA/Ao è di solito significativamente più alto di questo valore 9. Al contrario, se in un cane con esordio acuto di tachipnea/dispnea le dimensioni del LA sono normali, si dovrebbero cercare inizialmente le cause di dispnea non cardiache. Le dimensioni dell’atrio destro (RA) possono essere valutate soggettivamente mediante POCUS toracica, utilizzando la vista a quattro camere sull’asse lungo a quattro camere parasternale destra o la vista apicale parasternale sinistra. Pertanto, se RA appare più grande di LA, potrebbe suggerire una dilatazione del RA, cosa che potrebbe spiegare la presenza di insufficienza cardiaca destra (versamento pleurico e/o ascite).
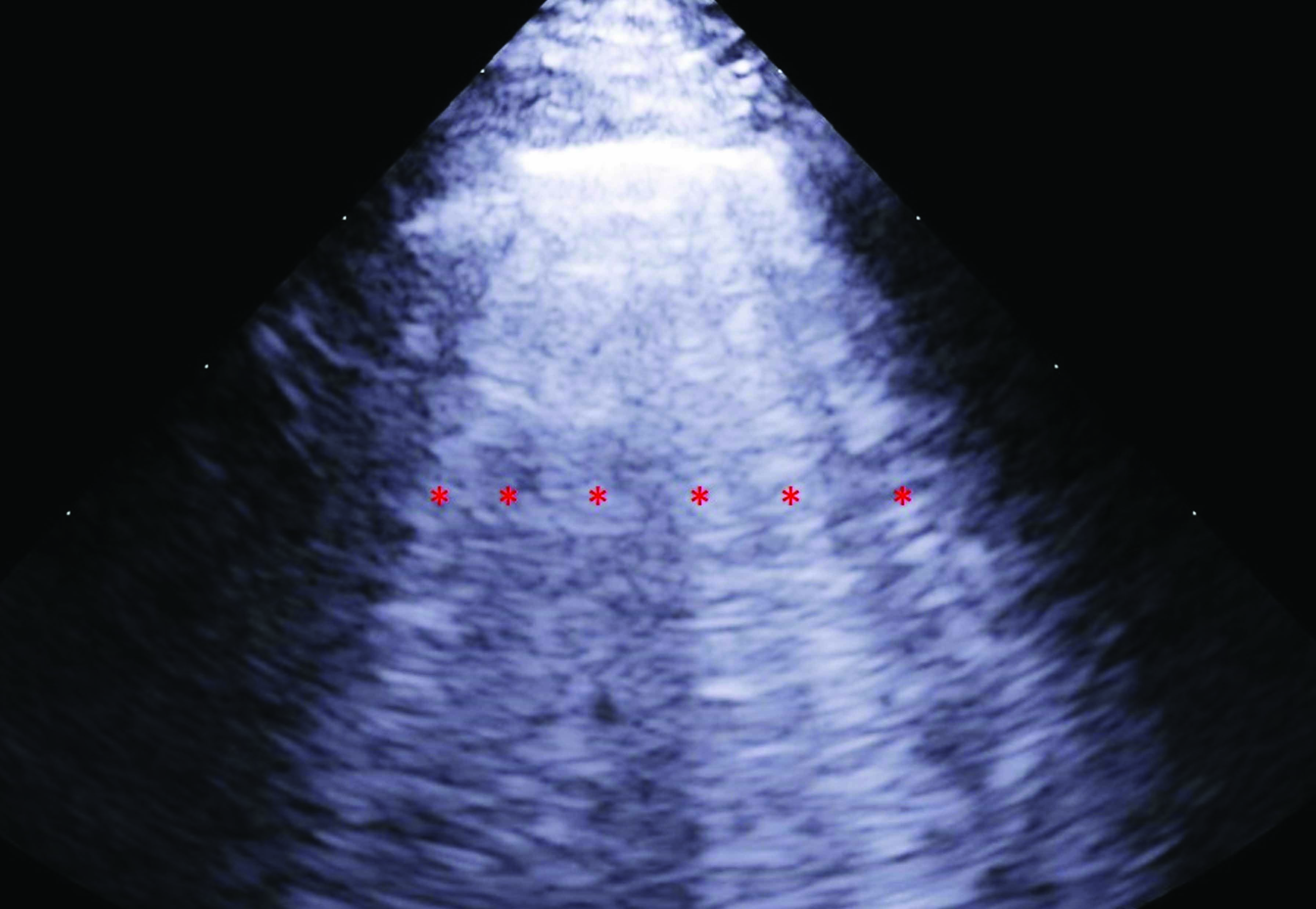
La POCUS può servire anche per identificare gli artefatti associati all’edema polmonare. In caso di edema polmonare acuto, si può notare un artefatto verticale iperecogeno, che nasce dalla linea pleurica, si estende fino al fondo dello schermo senza sbiadire, e si muove in sincrono con lo scorrimento del polmone. Queste “linee B” sono costituite da una scia di echi densi, che ricorda la coda di una cometa orientata distalmente, ed è generata dai riverberi ultrasonici prodotti dall’accumulo di fluido negli spazi alveolari. Le linee B possono essere rilevate utilizzando una sonda ad array di fase o una sonda curvilinea, e la diagnosi di edema polmonare richiede generalmente l’identificazione di 3 o più linee B. Il numero di linee B corrisponde generalmente alla gravità dell’edema polmonare sottostante, e può anche essere correlato al grado di miglioramento dopo la terapia 10,11,12. Tuttavia, gli artefatti della linea B non sono patognomonici dell’edema polmonare, e possono essere osservati in una varietà di altre condizioni, inclusi pazienti dispnoici con contusioni polmonari, polmonite, sindrome da distress respiratorio acuto (ARDS), fibrosi polmonare e, talvolta, persino in soggetti sani 12 (Figura 1).
 |
 |
| a | b |
 |
 |
| c | d |
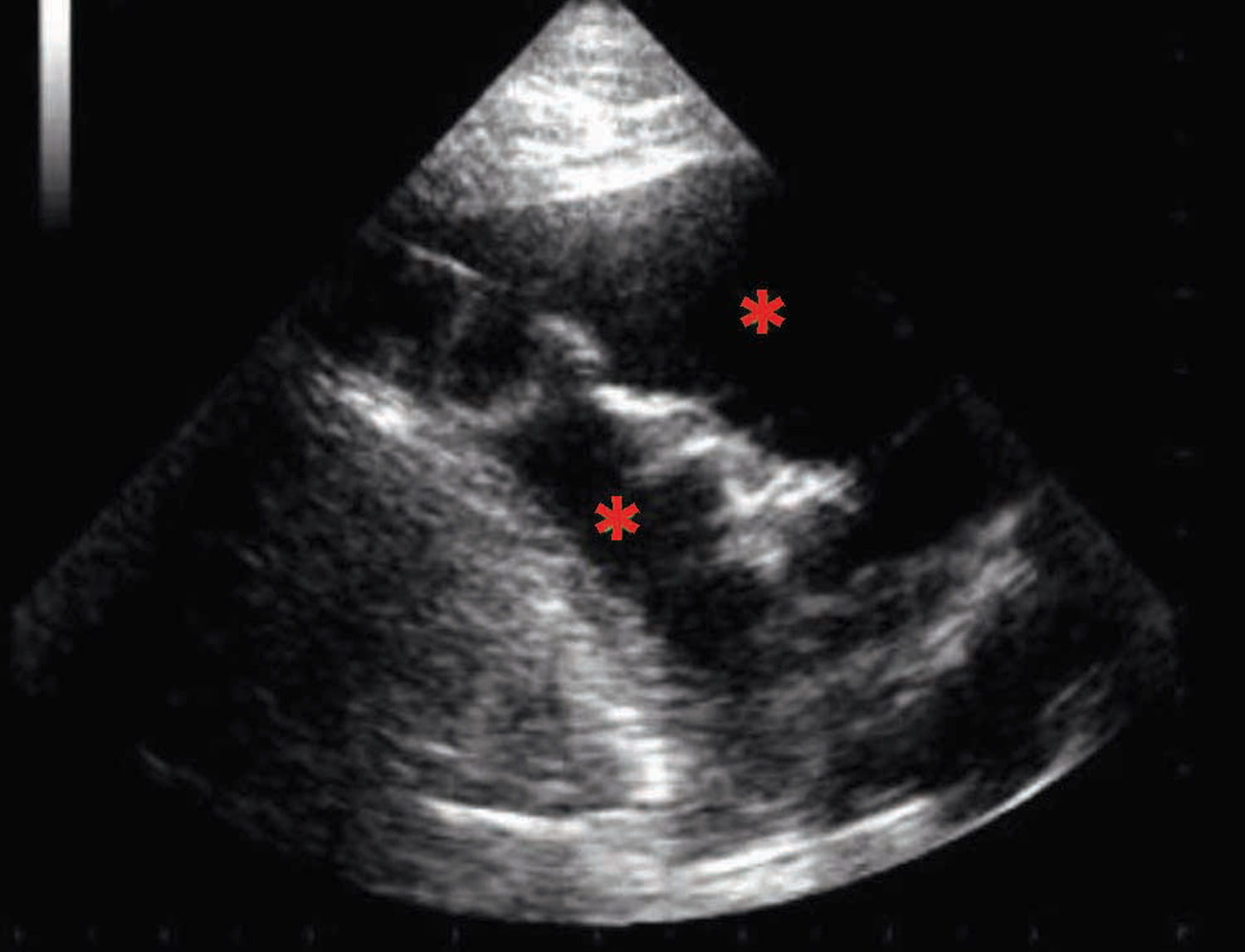
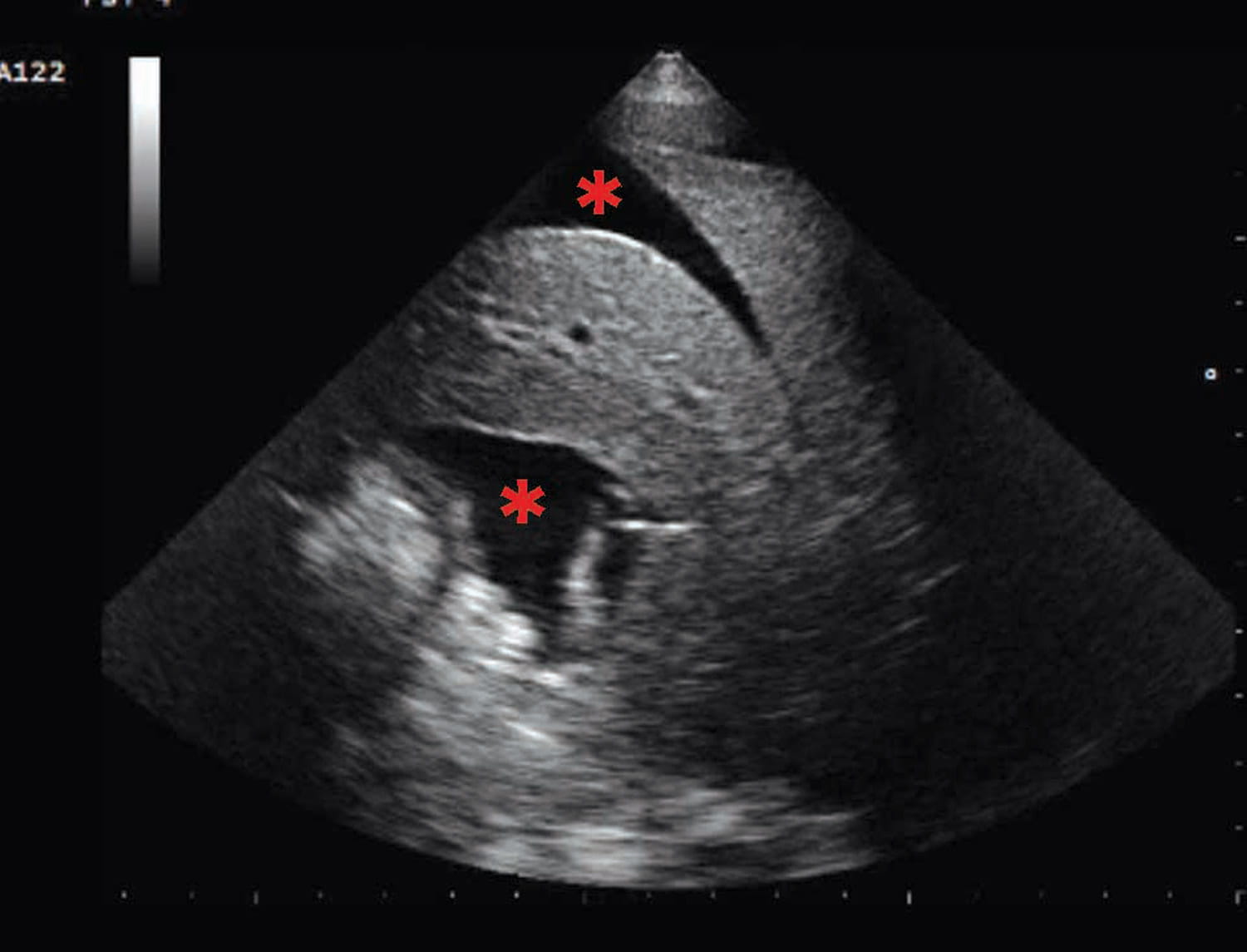
Figura 1. Immagini da ecografia point-of-care (POCUS) di cani con insufficienza cardiaca acuta. (a) vista in asse corto parasternale destro a livello della base del cuore che mostra l’atrio sinistro (LA) significativamente aumentato rispetto alla sezione aortica (Ao); (b) code di cometa, ovvero artefatti delle linee B (contrassegnati con * rosso) compatibili con la presenza di edema polmonare; (c) versamento pleurico caratterizzato da aree ipoecogene nella cavità toracica (contrassegnate con * rosso); (d) ascite rivelata dalla presenza di un’area ipoecogena nella cavità addominale (contrassegnata con * rosso).
© Luca Ferasin
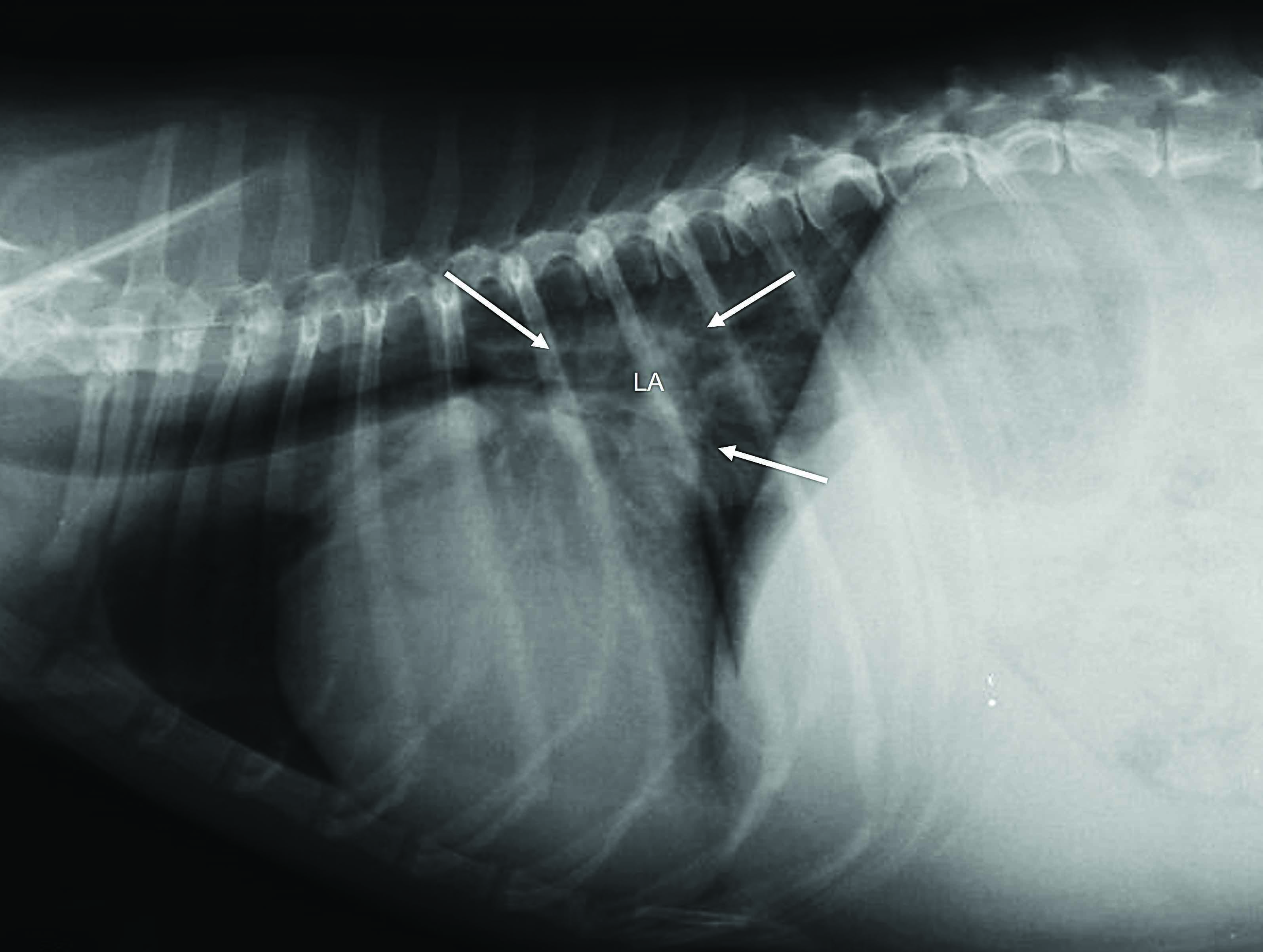
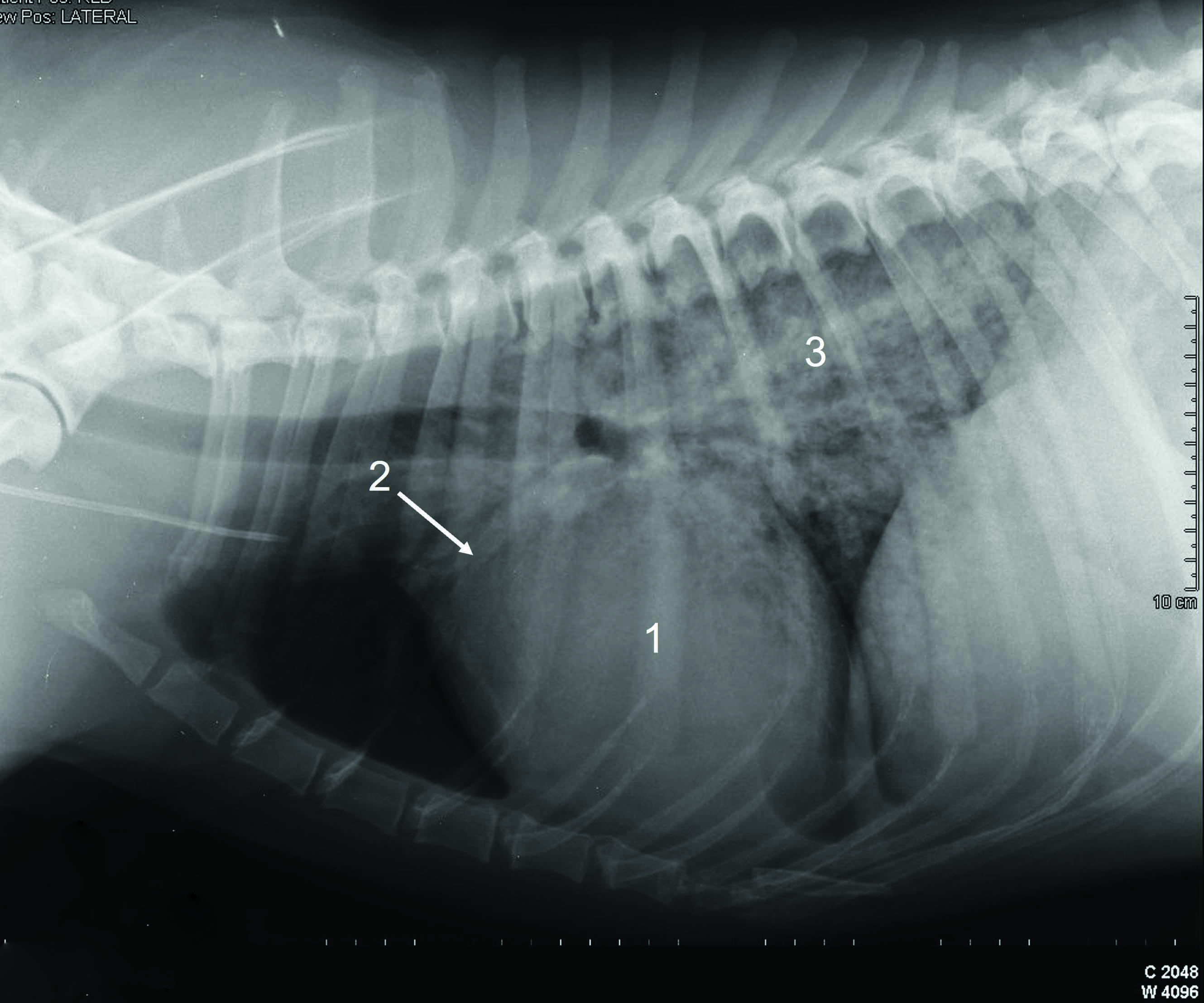
Nei casi di dispnea potenzialmente letale, e quando l’ecografia non è prontamente disponibile, se la presentazione clinica completa suggerisce un esordio acuto di CHF, prima della conferma radiografica dell’edema polmonare può essere giustificata la somministrazione parenterale di furosemide 13. La radiografia toracica è ancora considerata da molti cardiologi lo standard di riferimento per confermare l’edema polmonare cardiogeno e i segni compatibili con l’HF destra. La maggior parte dei cani non richiede alcun contenimento fisico per la radiografia, minimizzando di conseguenza il rischio di ulteriore stress, e infatti (come notato in precedenza) i cani con AHF dovrebbero essere sedati prima di qualsiasi test diagnostico, poiché questo tende ad aumentare significativamente la loro compliance. La collocazione corretta può essere facilitata con l’uso di sacchi di sabbia e posizionatori in gommapiuma. Se è stato rilevato un versamento pleurico mediante percussione toracica e al POCUS, è necessario eseguire una toracocentesi completa prima della radiografia; questo minimizza lo stress aggiuntivo, migliora la funzione respiratoria, e facilita la visualizzazione dei campi polmonari altrimenti oscurati dal fluido presente nella cavità toracica. La diagnosi radiografica dell’edema polmonare cardiogeno richiede l’identificazione della triade di alterazioni, cioè cardiomegalia, presenza di congestione venosa polmonare, e pattern alveolare/interstiziale diffuso, particolarmente pronunciato nei campi polmonari caudali. La cardiomegalia può essere confermata da una valutazione obiettiva, oppure misurando il punteggio della scala cardiaca vertebrale (VHS), che dovrebbe essere superiore a 10,5 14. Recentemente è stato inoltre descritto un metodo per valutare le dimensioni dell’atrio sinistro sulle radiografie toraciche 15. Quando si interpreta una dilatazione atriale sinistra pronunciata è necessario prestare particolare attenzione poiché questa viene talvolta interpretata erroneamente come “edema peri-ilare” dai medici veterinari meno esperti (Figura 2).
 |
| a |
 |
| b |
Figura 2. Radiografie toraciche di cani con cardiopatia avanzata. (a) Cardiomegalia grave particolarmente marcata a livello dell’atrio sinistro (LA) come indicato dalle frecce. Questo segno viene spesso interpretato erroneamente dai medici veterinari inesperti come “edema peri-ilare”. Nonostante questo cane abbia segni evidenti di cardiomegalia, le vene polmonari non appaiono particolarmente congeste e non vi sono segni riconducibili a un pattern interstiziale-alveolare che possa suggerire la presenza di edema polmonare; (b) radiografia di un cane con dispnea a esordio acuto che mostra la tipica triade di alterazioni radiografiche, cioè 1 cardiomegalia, 2 presenza di congestione venosa polmonare e 3 pattern polmonare alveolare/interstiziale diffuso, che è particolarmente pronunciato nei lobi caudali.
© Luca Ferasin
Sebbene esperti di cardiologia abbiano proposto linee guida terapeutiche generali, va sottolineato che non sono stati finora pubblicati studi clinici prospettici sui cani con AHF 7,10. Le seguenti raccomandazioni riflettono quindi lo stato dell’arte della medicina clinica attuale, invece dell’inoppugnabile medicina basata sulle evidenze decisiva, e provengono dalle esperienze aneddotiche dell’autore e dall’evidenza estrapolata da studi clinici, linee guida, e dichiarazioni di consenso della medicina umana 1.
Prima di discutere la terapia farmacologica, vanno subito considerate le tre misure principali da adottare per qualsiasi cane con anamnesi e segni clinici compatibili con l’AHF, e cioè minimizzazione dello stress, sedazione, e integrazione con ossigeno; prima di emettere una diagnosi definitiva di insufficienza cardiaca sono spesso necessarie tutte queste misure.
 |
 |
| a | b |
 |
 |
| c | d |
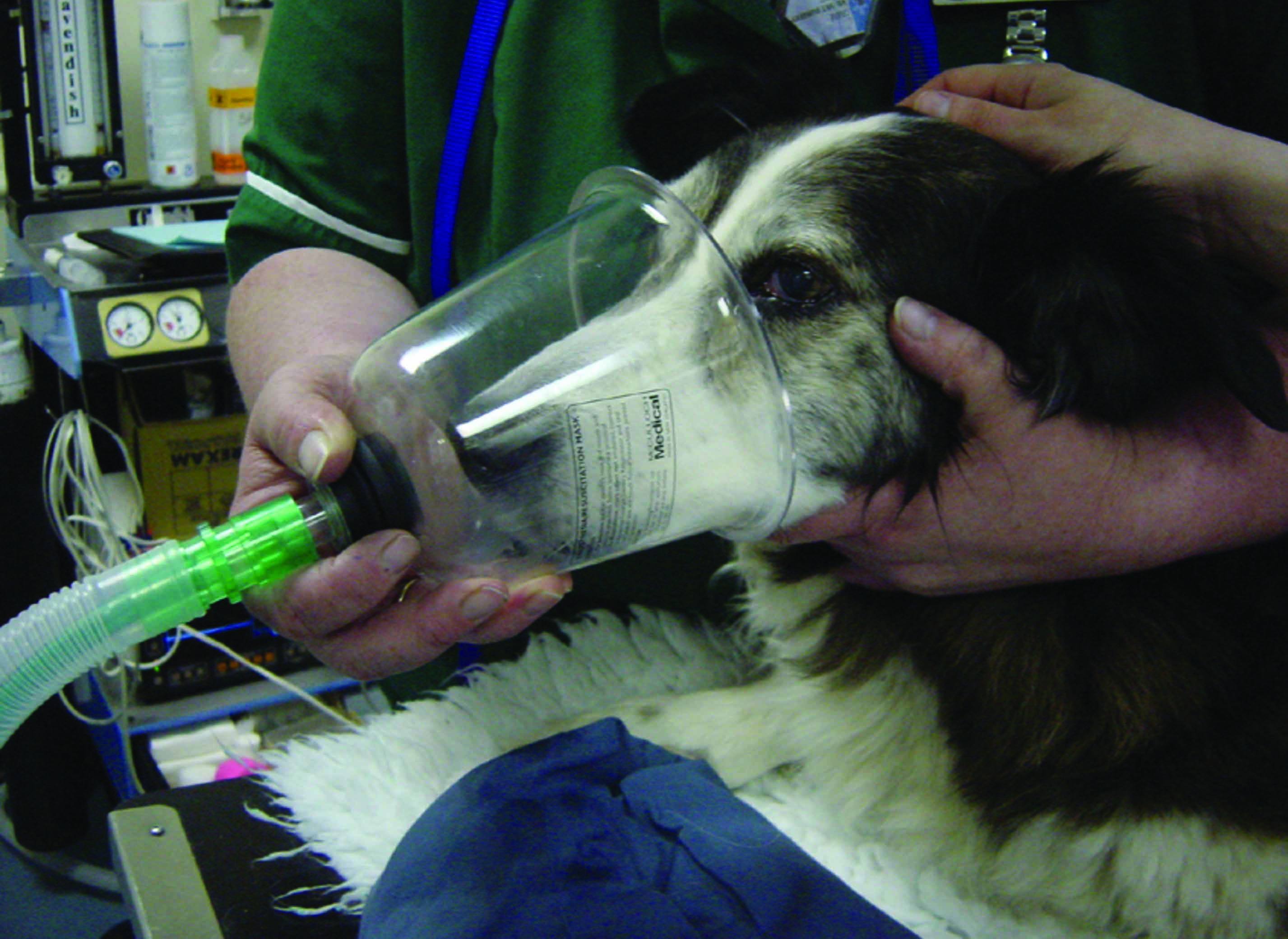
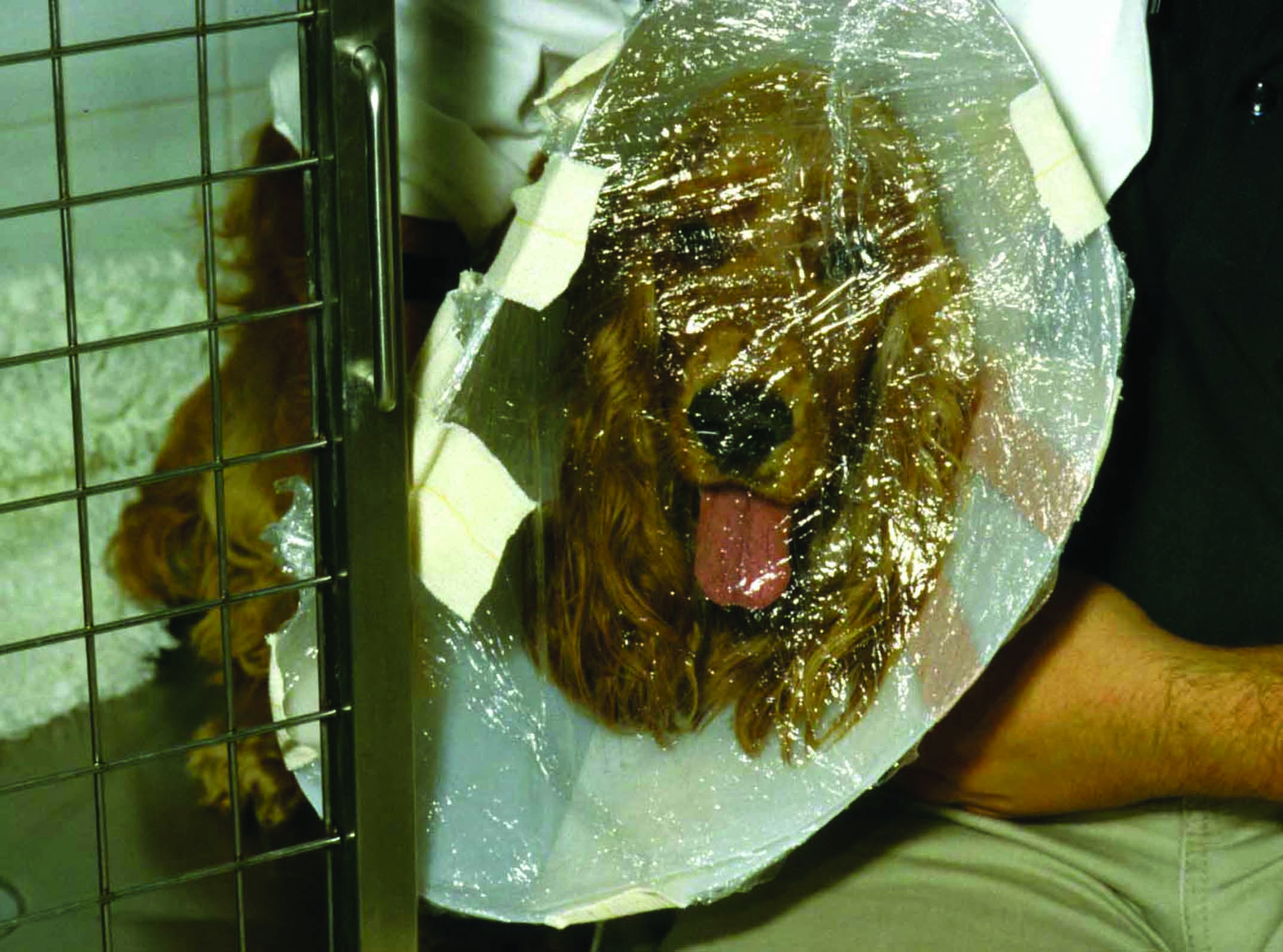
Figura 3. Esempi di diverse tecniche per l’integrazione con ossigeno nei cani con insufficienza cardiaca a esordio acuto. (a) maschera a ossigeno; sebbene sia spesso usata nelle emergenze dei piccoli animali, alcuni cani non tollerano la maschera e potrebbe essere preferibile una somministrazione con tecnica a flusso continuo. (b) rebbi nasali; possono fornire un apporto di ossigeno migliore rispetto al metodo a flusso libero e sono generalmente ben tollerati, specialmente dopo la sedazione. (c) gabbie e tende a ossigeno; sono uno dei metodi più accettati dai cani dispnoici. (d) metodo con collare di Elisabetta e sacchetto di plastica; è consigliabile evitarlo dati l’arricchimento con ossigeno non prevedibile, il rischio di surriscaldamento e la rimozione inadeguata di CO2, con successivo accumulo che potrebbe compromettere la stabilità clinica del cane dispnoico.
© Luca Ferasin
I diuretici promuovono l’aumento della produzione di urina e riducono i segni di congestione, in particolare l’edema polmonare, sebbene non migliorino direttamente la gittata cardiaca e possano causare compromissione della perfusione renale, anomalie elettrolitiche, e ulteriore attivazione del sistema renina-angiotensina-aldosterone (SRAA) 20. Una terapia diuretica valida deve fornire un sollievo rapido e completo dagli effetti dell’AHF, e tale terapia va quindi proseguita dopo la risoluzione per evitare la recidiva 21.
In generale, i diuretici riducono il volume plasmatico circolante, cosa che provoca lo spostamento dell’acqua dagli spazi interstiziali e alveolari dei polmoni allo spazio intravascolare, con conseguente miglioramento dello sforzo respiratorio e rendendo il paziente più rilassato. I diuretici d’ansa (ad es. furosemide e torasemide) sono quelli usati più spesso, ma sono di per sé piuttosto inefficaci nel controllare volumi elevati di versamento pleurico e/o di ascite (che vanno alleviati mediante rimozione meccanica) e sono controindicati nella maggior parte dei casi di versamento pericardico. La furosemide iniettabile viene sempre utilizzata per l’esordio acuto di CHF, con la dose adattata al singolo paziente, dato che l’eccesso può determinare effetti deleteri sulla perfusione renale (azotemia) e sulla deplezione di elettroliti (ipokaliemia, iponatriemia, ipocloremia, ipomagnesiemia, e ipocalcemia), soprattutto nei cani anziani 22. D’altra parte, un sottodosaggio di furosemide può causare insuccesso terapeutico, ospedalizzazione prolungata, e potenziale eutanasia a causa dell’insufficienza cardiaca refrattaria. Se possibile, la furosemide deve essere somministrata per via endovenosa per ottenere un rapido esordio d’azione e una biodisponibilità più prevedibile; tuttavia le iniezioni intramuscolari possono rappresentare un’alternativa ragionevole in alcuni cani che non collaborano, sebbene l’effetto terapeutico possa essere ritardato. L’autore preferisce la furosemide alla dose di 4 mg/kg EV nei pazienti gravemente scompensati, e 2 mg/kg per quelli con congestione lieve-moderata; il miglioramento clinico iniziale è prevedibile circa 30 minuti dopo la somministrazione. A seconda della gravità dell’edema polmonare sottostante, possono essere indicati boli endovenosi (IVB) ripetuti o l’avvio di un’infusione a velocità costante (CRI, con 0,66 mg/kg/ora entro 8 ore) di furosemide 23. La CRI era un tempo raccomandata per aumentare l’effetto diuretico, riducendo al tempo stesso il rischio di ischemia renale causato dai cambiamenti improvvisi del volume vascolare. Tuttavia, uno studio recente non sembra confermare l’ipotesi che l’aggiunta della CRI a una dose di carico mediante IVB di furosemide possa migliorare gli esiti a breve termine nei cani con AHF e, sebbene sia l’IVB che la CRI siano quasi altrettanto efficaci nell’alleviare il distress respiratorio, la CRI potrebbe comportare un rischio maggiore di disidratazione e azotemia, mentre la somministrazione con IVB può essere associata a un ricovero più lungo e potrebbe richiedere dosi maggiori. Pertanto, la terapia con furosemide per l’AHF canina dovrebbe considerare la presenza di comorbilità, come ad esempio una nefropatia concomitante, delle risorse disponibili, della dose totale di furosemide, ecc. 24.
Il monitoraggio della frequenza respiratoria e dello sforzo respiratorio ogni 30-60 minuti guida l’ulteriore somministrazione di furosemide. Se la dose e la frequenza sono efficaci, entro poche ore dovrebbe essere evidente una riduzione graduale della frequenza respiratoria e dello sforzo respiratorio, e in base alla risposta alla prima dose, si possono stimare le dosi successive di furosemide e la frequenza delle iniezioni. Un approccio empirico consiste nel considerare una dose massima cumulativa di 12 mg/kg/die 7.
Luca Ferasin
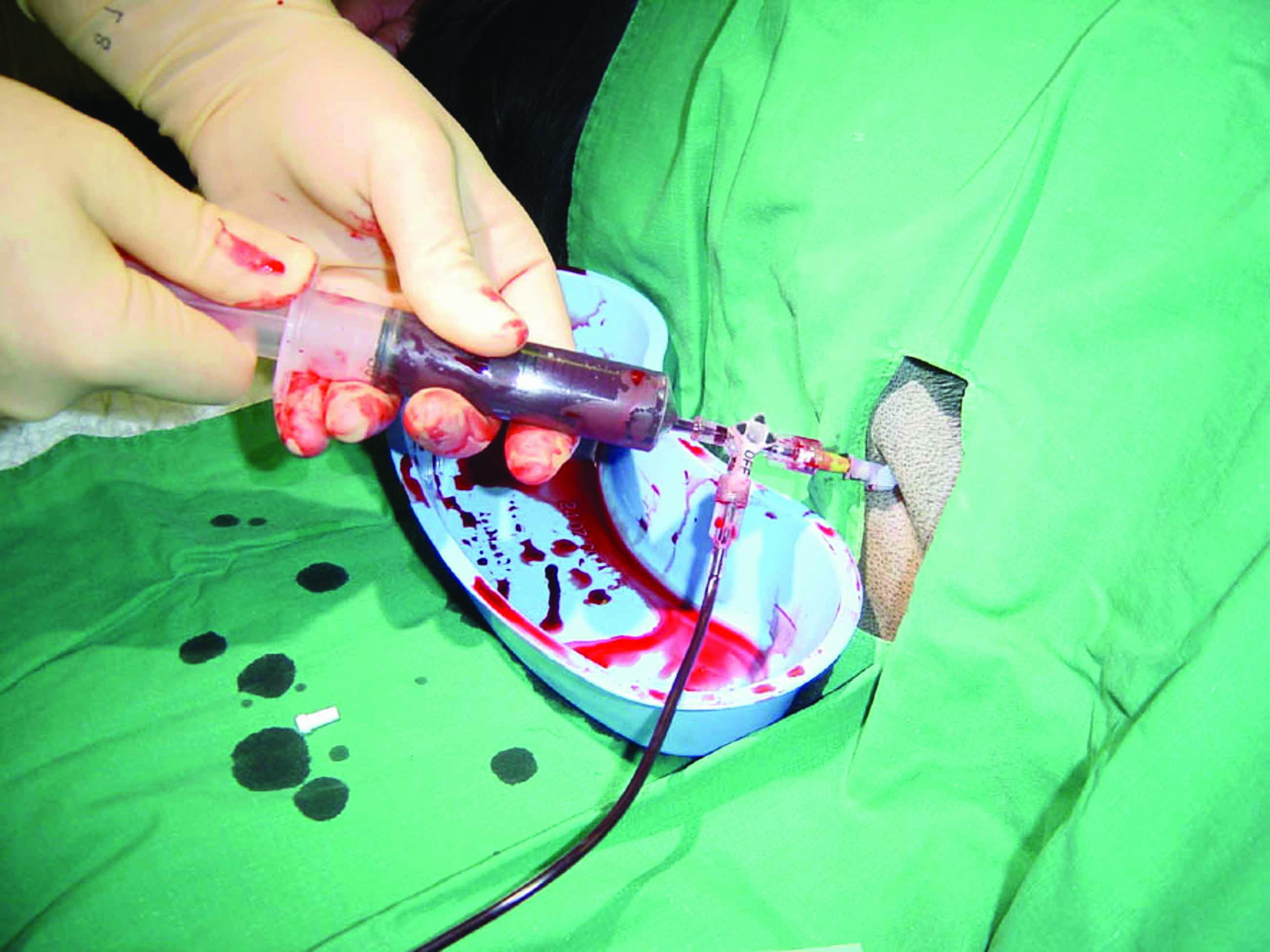
La decisione di eseguire il drenaggio meccanico nel cane con versamento pleurico, versamento pericardico, o ascite deve considerare il rapporto rischi/benefici della procedura. Ad esempio, un’ascite lieve o un versamento pleurico o pericardico di modesta entità, spesso associato a edema polmonare concomitante, può rispondere alla sola diuresi. Tuttavia, quando il volume di accumulo di fluidi è abbastanza grave da contribuire ai segni clinici alla presentazione, si raccomanda sempre la centesi (Figura 4), e le tecniche più comuni (toracocentesi, addominocentesi, pericardiocentesi) sono relativamente sicure e semplici; le complicanze iatrogene sono un raro riscontro. Le sedi di inserimento dell’ago per il primo e il terzo metodo possono essere facilmente identificate grazie all’esame obiettivo o alle radiografie toraciche, sebbene la guida ecografica sia attualmente l’alternativa preferita per la maggior parte dei medici veterinari.
 |
 |
| a | b |
 |
 |
| c | d |
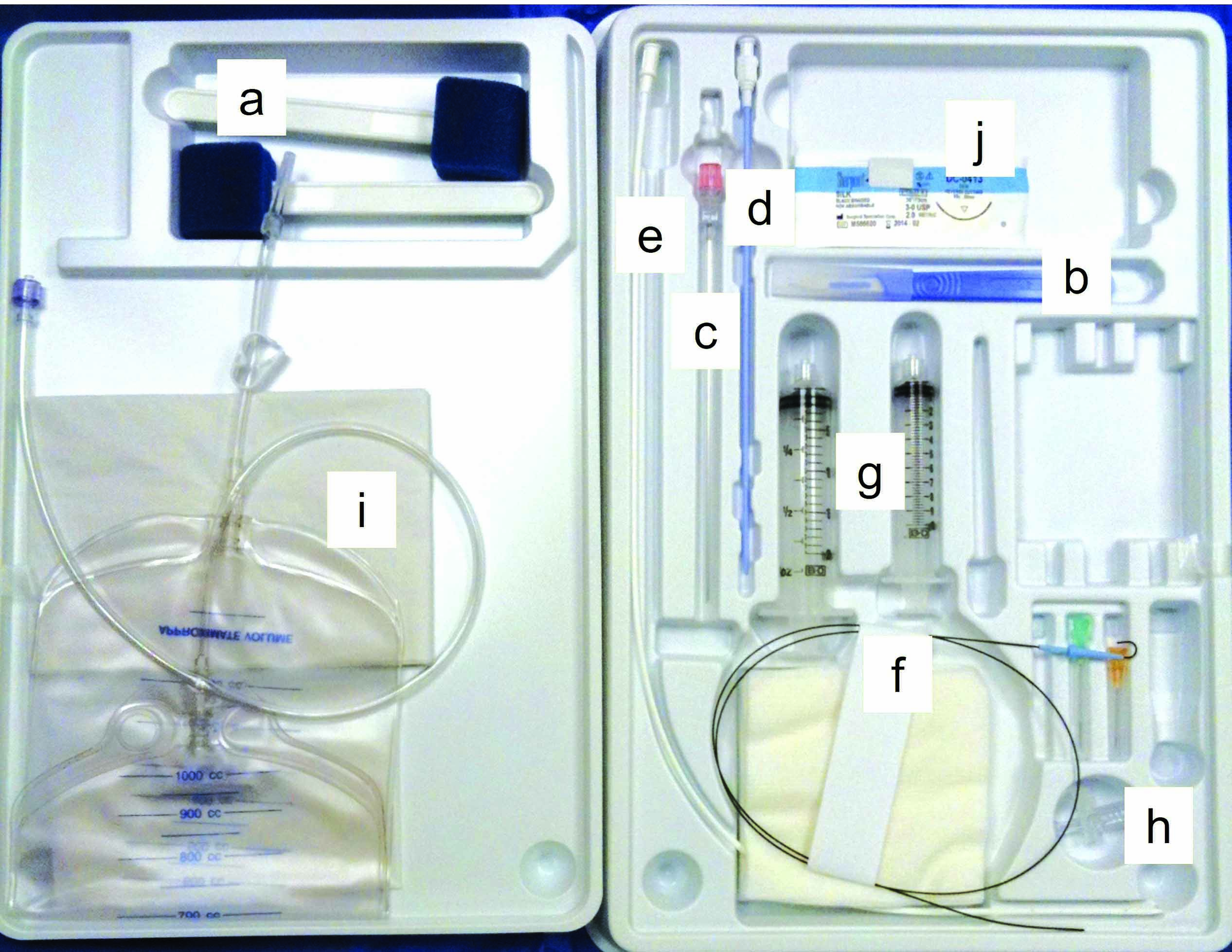
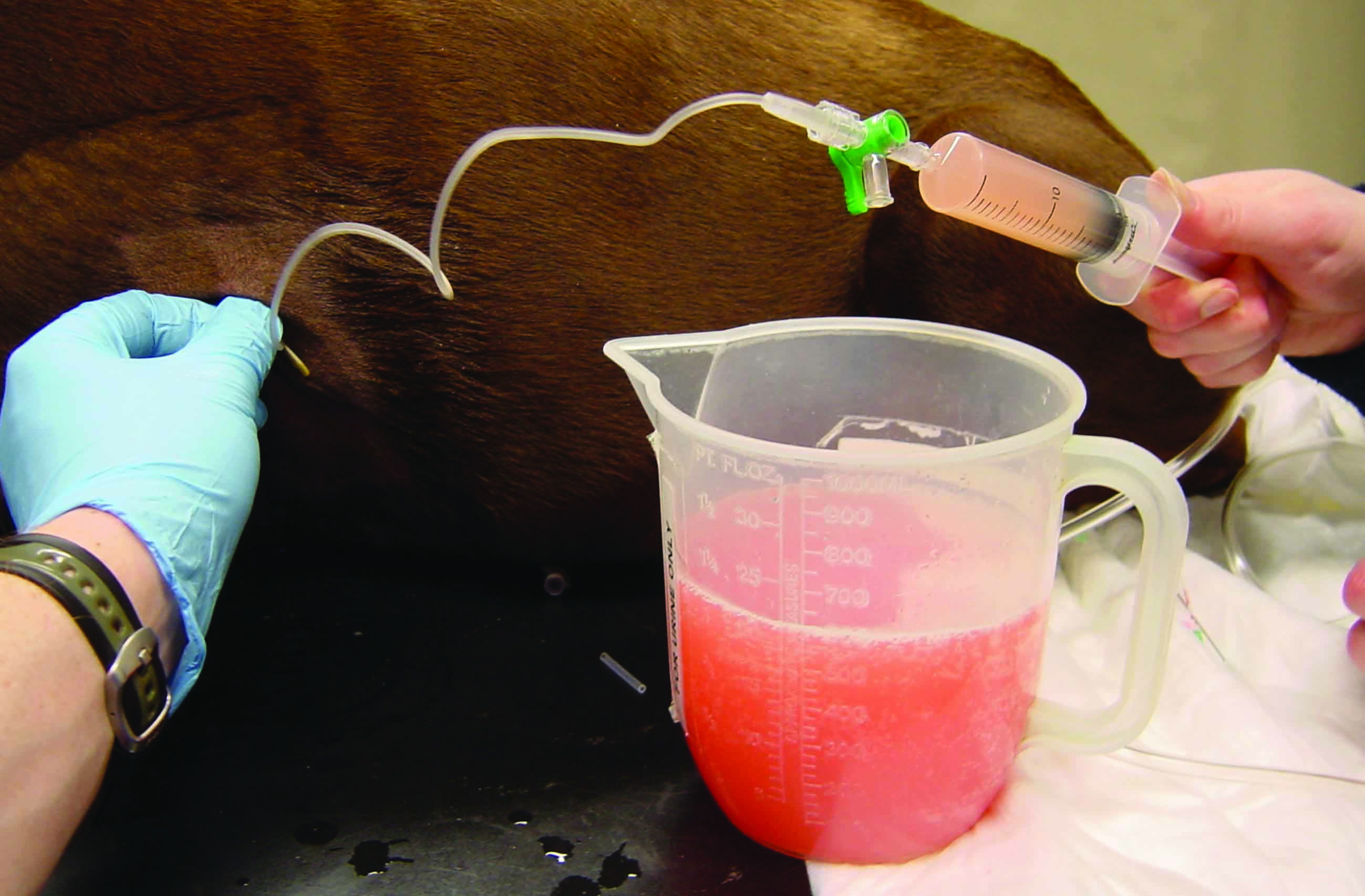
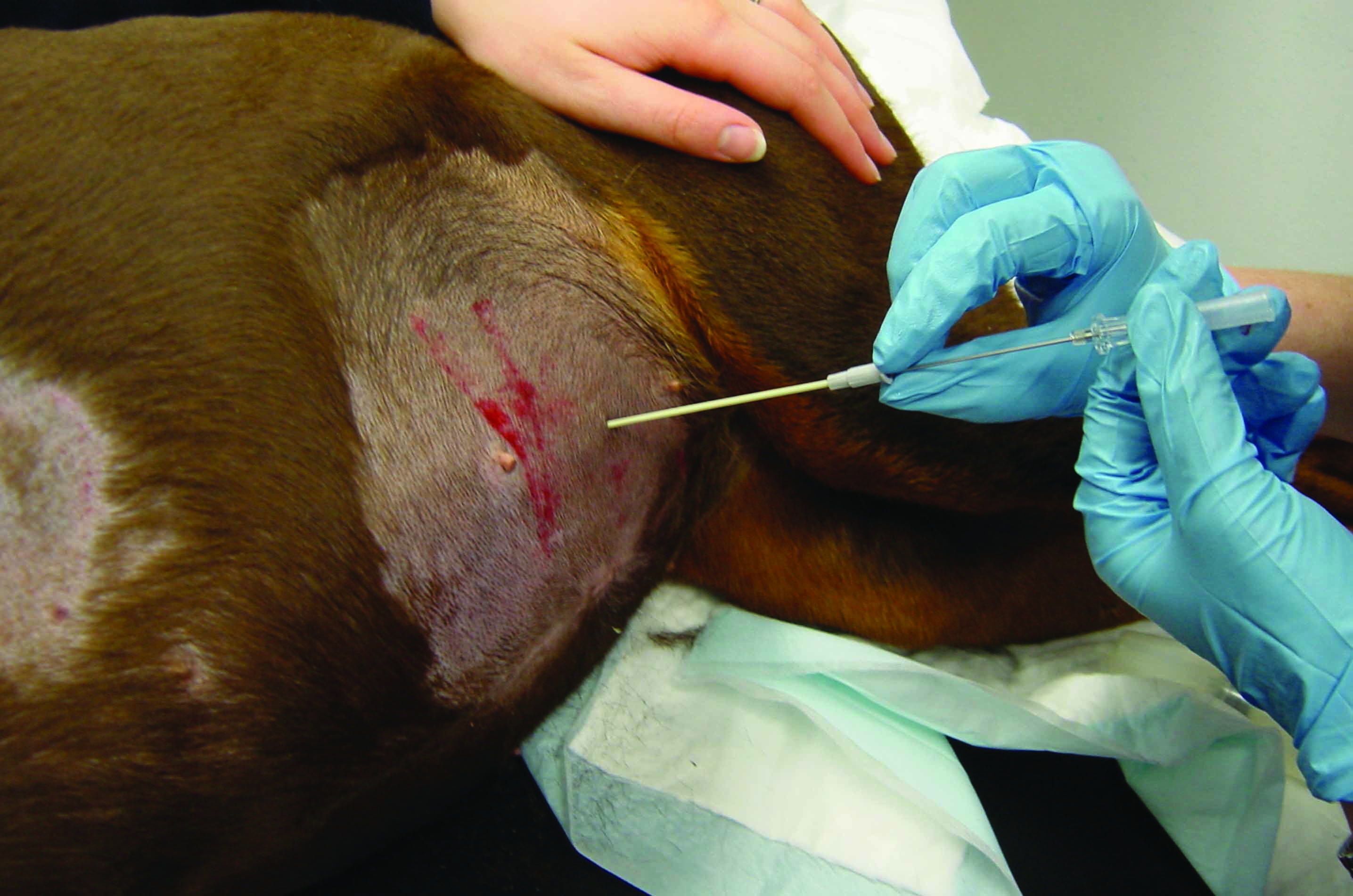
Figura 4. Attrezzature e tecniche per la centesi. (a) set da centesi basato sulla tecnica con filo guida di Seldinger; a: tamponi per scrubbing cutaneo; b: lama per bisturi; c: ago; d: dilatatore; e: catetere; f: filo guida; g: siringhe con attacco Luer-Lock; h: rubinetto a tre vie; i: sacca di prelievo; j: materiale da sutura. (b) toracocentesi eseguita in un cane con versamento pleurico utilizzando un ago a farfalla; (c) inserimento di un catetere prefenestrato nell’addome per alleviare una forma grave di ascite (addominocentesi); (d) pericardiocentesi eseguita utilizzando un catetere morbido prefenestrato; la maggior parte dei versamenti pericardici è caratterizzata dall’accumulo di fluido sieroematico.
© Luca Ferasin
La toracocentesi si esegue inserendo un ago nella cavità toracica a livello del 7-8° spazio intercostale, nel terzo inferiore e medio, entrando nello spazio pleurico davanti alla costa per evitare i vasi e i nervi che scorrono lungo l’aspetto caudale delle coste. La maggior parte dei versamenti può essere drenata su un solo lato, data la presenza di un’ampia fenestrazione mediastinica, e la centesi bilaterale non è solitamente necessaria. La procedura deve essere eseguita con il cane in decubito sternale con adeguato contenimento manuale, fornendo eventualmente ossigeno supplementare. È possibile utilizzare un set per centesi dedicato, un ago a farfalla, o un ago-cannula da toracocentesi attaccato alla linea di estensione, e ognuno di esse comporta vantaggi e svantaggi. Un rubinetto a 3 vie o una valvola da centesi unidirezionale accelera la procedura e minimizza il movimento. L’ago a farfalla, ad esempio, funziona bene con i cani di taglia piccola, ma tale ago non è abbastanza lungo da essere introdotto e collocato in sicurezza nei cani di taglia maggiore, dove gli aghi-cannula da toracocentesi (16 G o 18 G) possono consentire una rimozione più completa e sicura del fluido pleurico una volta inseriti nella cavità toracica. Per questa tecnica, l’autore preferisce utilizzare una piccola dose di lidocaina per minimizzare il disagio del paziente associato all’inserimento dell’ago. Gli svantaggi del sistema di ago-cannula da toracocentesi riguardano il tempo di preparazione più lungo, soprattutto se si eseguono fenestrazioni, la necessità di un’incisione di rilascio e di un blocco locale nella cute, nonché le difficoltà per inserire il catetere nel torace. Esiste inoltre un rischio che il catetere si rompa, con conseguente permanenza nella cavità toracica di un suo piccolo pezzo. Il medico veterinario deve prestare particolare attenzione mentre ritrae il mandrino dell’ago quando il catetere è avanzato nel torace, poiché ciò può causare attorcigliamenti o perdita della corretta collocazione nella cavità toracica 13. I set per centesi dedicati forniscono un filo guida morbido che può essere inserito attraverso un ago cavo affilato, e se il filo guida viene collocato correttamente, può essere lasciato in posizione e scambiato con un catetere morbido prefenestrato che sarà poi fatto avanzare nella cavità toracica (tecnica di Seldinger). Tutte queste tecniche funzionano bene in mani esperte, motivo per cui la decisione è una preferenza personale. Dopo la toracocentesi, occorre monitorare strettamente la frequenza respiratoria e lo sforzo respiratorio, ed è prevedibile un miglioramento significativo entro pochi minuti; tuttavia, è consigliabile che il monitoraggio prosegua costantemente nelle ore successive per garantire che non si sviluppi uno pneumotorace iatrogeno.
L’addominocentesi va considerata quando un’ascite troppo voluminoso interferisce con la respirazione e provoca eccessivo disagio nel paziente. Anche in questo caso la procedura può essere eseguita con successo utilizzando un ago a farfalla (nei cani di taglia piccola) o un ago-cannula da toracocentesi fenestrato. L’autore predilige una tecnica ibrida che utilizza cannule da fistola (chiamate anche aghi fistola), che sono specificamente progettate per la cannulazione richiesta dall’emodialisi. Sono simili agli aghi a farfalla ma tendono ad avere calibro maggiore; inoltre, l’ago è dotato di un foro laterale (“occhio posteriore”) che serve a massimizzare il flusso dal punto di accesso; anche in questo caso, la scelta dipende dalle preferenze del medico veterinario, sebbene la guida ecografica consenta di identificare la raccolta di fluido più voluminosa in modo da ottimizzare il drenaggio ed evitare di forare gli organi addominali e i vasi principali.
Il versamento pericardico nei cani è causato spesso da tumori cardiaci, sebbene molti casi abbiano eziologia sconosciuta (versamento idiopatico); quando la quantità di fluido nel sacco pericardico è abbastanza grave da causare segni di tamponamento cardiaco, solitamente accompagnato dal collasso della parete atriale, è necessario eseguire la pericardiocentesi. Per questa procedura, il cane va collocato in decubito sternale o laterale sinistro, a seconda del comportamento, del grado di sedazione, e delle preferenze del medico veterinario. La sede ottimale per la pericardiocentesi è generalmente il lato destro, a livello del 4-5° spazio intercostale, appena in corrispondenza o sopra la giunzione costocondrale, e per identificare il punto ideale di inserimento dell’ago si usa spesso l’ecografia. Anche in questo caso sono disponibili vari metodi, anche se l’autore preferisce l’uso di set da pericardiocentesi dedicati con cateteri morbidi prefenestrati inseriti con la tecnica di Seldinger sotto anestesia locale. Per rilevare le eventuali aritmie indotte dall’ago o dal catetere si utilizza un monitoraggio ECG continuo. Se l’esecuzione è corretta, il tasso di complicanze della pericardiocentesi è basso, ma occorre discutere i rischi con il proprietario prima di tentare la procedura. L’uso dei diuretici nel versamento pericardico è spesso sconsigliato perché possono ridurre il pre-carico cardiaco già di per sé compromesso. Tuttavia, il versamento pericardico può anche essere secondario all’insufficienza cardiaca destra, sebbene in questo caso abbia un volume solitamente basso e si risolva spesso con i soli diuretici.
Luca Ferasin
Nei pazienti umani con edema polmonare acuto, gli agenti inotropi positivi possono facilitare la risoluzione dell’AHF a prescindere dall’eziologia, data la capacità di questi agenti di migliorare la funzione miocardica. Il pimobendan è stato utilizzato con maggiore frequenza nella gestione dell’AHF canina grazie al suo meccanismo d’azione doppio di sensibilizzazione al calcio (che migliora la contrattilità con effetti minimi sul consumo di ossigeno del miocardio) e di inibizione della fosfodiesterasi (che promuove la vasodilatazione periferica). In molti paesi è disponibile una forma iniettabile che può essere somministrata ai cani con AHF, soprattutto in presenza di disfunzione sistolica ventricolare sinistra, versamento pleurico significativo, insufficienza renale, o edema polmonare refrattario grave. La dobutamina (un agente inotropo positivo adrenergico con effetti principalmente sul recettore beta-1) può essere considerata anche nei cani con insufficienza cardiaca acutamente scompensata caratterizzata da riduzione della gittata cardiaca. Va considerata la somministrazione endovenosa, soprattutto per il paziente con primo evento di insufficienza cardiaca con disfunzione sistolica. La dose è di 1-10 mcg/kg/minuto mediante CRI, iniziando con una dose bassa e poi aumentando la titolazione in base al monitoraggio della pressione arteriosa e dell’ECG, poiché l’ipertensione e le tachiaritmie sono gli effetti avversi principali 7.
Si può considerare che farmaci come ad esempio i nitrati (ad es. nitroglicerina, nitroprussiato di sodio) che promuovono la dilatazione arteriosa e venosa riducono il post-carico e migliorano la gittata cardiaca in caso di insufficienza cardiaca, poiché il post-carico è spesso elevato nello scompenso cardiaco a causa della sovraregolazione del sistema nervoso simpatico e all’attivazione del sistema renina-angiotensina-aldosterone (SRAA). La nitroglicerina dilata in modo potente le grandi arterie (comprese le arterie coronarie) e le vene, ma ha un effetto minore sulle arteriole più piccole; è disponibile in varie formulazioni, ma l’unguento al 2% è il prodotto utilizzato più spesso nei piccoli animali, e viene generalmente applicato localmente in combinazione con i diuretici nella gestione acuta dell’insufficienza cardiaca grave per ridurre ulteriormente il pre-carico. Il nitroprussiato di sodio è un dilatatore venoso e arterioso potente che dilata la vascolarizzazione polmonare e quella sistemica, pur potendo causare marcata ipotensione. Si raccomanda una dose iniziale bassa (0,1-0,2 mcg/kg/minuto), sovratitolando in base alla pressione arteriosa, e puntando a ottenere una pressione arteriosa media di 70 mmHg o una pressione arteriosa sistolica di 90-100 mmHg 8. Si raccomanda il monitoraggio continuo della pressione arteriosa per ridurre il rischio di ipotensione grave. In assenza di ipotensione sistemica, l’uso di nitrati sembra essere sicuro ed efficace, e associato al miglioramento dei sintomi e alla riduzione della mortalità nei cani con AHF.
Questi agenti devono essere usati con cautela nei cani con insufficienza cardiaca. Nella maggior parte dei casi, il controllo efficiente della congestione e il miglioramento della gittata cardiaca migliorano indirettamente l’aritmia, e quindi le aritmie di basso grado non vengono generalmente trattate. Tuttavia, in presenza di tachiaritmie ventricolari e sopraventricolari emodinamicamente significative, si raccomanda un trattamento antiaritmico specifico. Sebbene la frequenza rapida comprometta la gittata cardiaca, un’altra preoccupazione importante è il danno miocardico indotto dalla tachicardia (tachicardiomiopatia) che può derivare da frequenze rapide sostenute per periodi prolungati, ed è noto che queste coinvolgono i pazienti con tachiaritmie ventricolari o sopraventricolari.
Per migliorare la gittata cardiaca e ridurre il rischio di tachicardiomiopatia nella fibrillazione atriale rapida (ad es. tasso di risposta ventricolare superiore a 180 bpm) l’autore raccomanda una terapia di controllo della frequenza con la somministrazione combinata di digossina + diltiazem. La digossina deve essere somministrata alla dose di 0,003-0,005 [come massimo] mg/kg PO 2x/die, con l’obiettivo di utilizzare la dose minima efficace, non la dose massima, e di non avere effetti indesiderati (come comunemente sostenuto in passato). È estremamente importante determinare il livello sierico di digossina 3-5 giorni dopo l’inizio del trattamento, e poi sempre 6-8 ore dopo la somministrazione (livello di valle). Il livello sierico terapeutico target attuale è 0,5-1,2 ng/mL (0,65-1,53 nmol/L), che è probabilmente inferiore a quello spesso segnalato in letteratura. Il diltiazem può essere somministrato a 2-5 mg/kg ogni 12 ore nella formulazione a rilascio prolungato in combinazione con la digossina. L’efficacia del trattamento della fibrillazione atriale va periodicamente monitorata, idealmente dopo 5-7 giorni e mediante registrazione Holter 24 ore ambulatoriale (frequenza media giornaliera target 100-120 bpm) 25. Tuttavia, se non disponibile, si raccomanda il monitoraggio ECG standard (frequenza target di circa 130-150 bpm), eseguito 5-7 giorni dopo l’avvio della terapia antiaritmica, e successivamente ogni 3-6 mesi.
Se viene diagnosticata una tachicardia ventricolare rapida e prolungata, deve essere considerata la somministrazione di lidocaina (2 mg/kg in bolo EV entro 1 minuto) seguita dalla CRI (0,025-0,1 mg/kg/minuto), monitorando i possibili effetti indesiderati (depressione, crisi convulsive, fascicolazioni muscolari, vomito, bradicardia e ipotensione). Se le reazioni sono gravi, è consigliabile ridurre o interrompere la somministrazione.
Altri eventuali interventi antiaritmici devono essere valutati attentamente. Ad esempio, avviare un betabloccante (ad es. propranololo, atenololo, sotalolo) nei cani con AHF potrebbe essere deleterio e va scoraggiato.
Alcuni casi gravi di AHF (caratterizzati da affaticamento muscolare respiratorio refrattario alla terapia medica) possono richiedere l’intubazione e la ventilazione meccanica come interventi salvavita. L’affaticamento muscolare respiratorio viene generalmente diagnosticato in base alla presenza simultanea di riduzione della frequenza respiratoria, ipercapnia, e compromissione del livello di coscienza. La ventilazione meccanica in questi cani sostiene l’apparato respiratorio e aumenta la sicurezza degli ulteriori test diagnostici, ma è costosa e richiede cure infermieristiche estensive, sistemi di ventilazione e competenze. Pertanto, qualsiasi decisione di offrire la ventilazione meccanica deve considerare, sia la prognosi per un recupero significativo del paziente, le attrezzature ospedaliere e le competenze, sia la disponibilità finanziaria e le aspettative del proprietario 13.
La frequenza respiratoria, lo sforzo respiratorio e la vitalità generale sono i parametri più importanti nel monitoraggio del cane con AHF. Un cane con edema polmonare cardiogeno grave migliora generalmente nel giro di alcune ore fino a un giorno dopo la terapia diuretica. Se entro un paio d’ore non si nota alcun miglioramento della frequenza respiratoria e dello sforzo respiratorio dopo una dose iniziale di furosemide, si raccomanda la ripetizione della dose. Una volta normalizzata la frequenza respiratoria e interrotta l’integrazione con ossigeno, è necessario avviare la titolazione della dose e stabilire la frequenza di somministrazione di furosemide. Se il cane resta clinicamente stabile dopo aver ridotto la dose di furosemide iniettabile, prima della dimissione occorre introdurre l’uso della furosemide (o della torasemide) orale. Inoltre, si raccomanda il monitoraggio della pressione arteriosa ogni 4-6 ore durante il ricovero, soprattutto se si utilizza una terapia vasodilatatoria aggiuntiva, mentre la misurazione dei parametri renali ed elettrolitici va eseguita idealmente prima di avviare il trattamento e ripetuta alcuni giorni dopo. In generale, i cani rispondono con successo al trattamento dopo il primo episodio di insufficienza cardiaca acutamente scompensata, con un tasso di sopravvivenza stimato alla dimissione che si avvicina all’80% 26.
Infine, una parte importante e spesso trascurata del successo nella gestione dell’emergenza dell’insufficienza cardiaca è una comunicazione franca con il proprietario del cane per quanto riguarda la capacità emotiva, pratica e finanziaria di affrontare la gestione a lungo termine delle condizioni dell’animale. È inoltre buona norma contattare i proprietari per il follow-up pochi giorni dopo la dimissione, e organizzare un controllo clinico dopo circa 1-2 settimane, a seconda delle singole circostanze.
|
Ringraziamenti
L’autore desidera ringraziare la Dr.ssa Heidi Ferasin per il suo contributo alla gestione di alcuni dei casi clinici riportati, e per la sua preziosa assistenza nella stesura di questo manoscritto.
|
Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guidelines for the Management of Heart Failure: Executive Summary. J. Am. Coll. Cardiol. 2022;79(17):1757-1780. Epub 20220401. DOI: 10.1016/j.jacc.2021.12.011. PubMed PMID: 35379504.
Ferasin L, Crews L, Biller DS, et al. Risk factors for coughing in dogs with naturally acquired myxomatous mitral valve disease. J. Vet. Intern. Med. 2013;27(2):286-292. Epub 20130209. DOI: 10.1111/jvim.12039. PubMed PMID: 23398050.
Ferasin L, Linney C. Coughing in dogs: what is the evidence for and against a cardiac cough? J. Small Anim. Pract. 2019;60(3):139-145. Epub 20190116. DOI: 10.1111/jsap.12976. PubMed PMID: 30652329.
Ljungvall I, Rishniw M, Porciello F, et al. Murmur intensity in small-breed dogs with myxomatous mitral valve disease reflects disease severity. J. Small Anim. Pract. 2014;55(11):545-550. Epub 20140912. DOI: 10.1111/jsap.12265. PubMed PMID: 25213440.
Ferasin L. Coughing. In; Textbook of Veterinary Internal Medicine. Ettinger SJ, Feldman EC, (eds.) 8th ed. St. Louis, MI: Saunders; 2016;107-110.
Chan SHH. Reinstatement of respiratory sinus arrhythmia as a therapeutic target of cardiac pacing for the management of heart failure. J. Physiol. 2020;598(3):433-434. Epub 20200115. DOI: 10.1113/JP279261. PubMed PMID: 31805609.
DeFrancesco TC. Management of cardiac emergencies in small animals. Vet. Clin. North Am. Small Anim. Pract. 2013;43(4):817-842. DOI: 10.1016/j.cvsm.2013.03.012. PubMed PMID: 23747262.
Tse YC, Rush JE, Cunningham SM, et al. Evaluation of a training course in focused echocardiography for noncardiology house officers. J. Vet. Emerg. Crit Care (San Antonio). 2013;23(3):268-273. Epub 20130506. DOI: 10.1111/vec.12056. PubMed PMID: 23647602.
Borgarelli M, Ferasin L, Lamb K, et al. DELay of Appearance of sYmptoms of Canine Degenerative Mitral Valve Disease Treated with Spironolactone and Benazepril: the DELAY Study. J. Vet. Cardiol. 2020;27:34-53. Epub 20200110. DOI: 10.1016/j.jvc.2019.12.002. PubMed PMID: 32032923.
DeFrancesco TC, Ward JL. Focused canine cardiac ultrasound. Vet. Clin. North Am. Small Anim. Pract. 2021;51(6):1203-1216. Epub 20210909. DOI: 10.1016/j.cvsm.2021.07.005. PubMed PMID: 34511294.
Taylor A, Anjum F, O’Rourke MC. Thoracic and lung ultrasound. StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK500013/ accessed 15/09/22
Dietrich CF, Mathis G, Blaivas M, et al. Lung B-line artefacts and their use. J. Thorac. Dis. 2016;8(6):1356-1365. DOI: 10.21037/jtd.2016.04.55. PubMed PMID: 27293860; PubMed Central PMCID: PMC4885976.
Ferasin L, DeFrancesco T. Management of acute heart failure in cats. J. Vet. Cardiol. 2015;17 Suppl 1:S173-189. DOI: 10.1016/j.jvc.2015.09.007. PubMed PMID: 26776576.
Boswood A, Haggstrom J, Gordon SG, et al. Effect of pimobendan in dogs with preclinical myxomatous mitral valve disease and cardiomegaly: the EPIC Study – a randomized clinical trial. J. Vet. Intern. Med. 2016;30(6):1765-1779. Epub 20160928. DOI: 10.1111/jvim.14586. PubMed PMID: 27678080; PubMed Central PMCID: PMC5115200.
Lee D, Yun T, Koo Y, et al. Change of vertebral left atrial size in dogs with preclinical myxomatous mitral valve disease prior to the onset of congestive heart failure. J. Vet. Cardiol. 2022;42:23-33. Epub 20220511. DOI: 10.1016/j.jvc.2022.05.003. PubMed PMID: 35675727.
Crane SD, Elliott MW, Gilligan P, et al. Randomised controlled comparison of continuous positive airways pressure, bilevel non-invasive ventilation, and standard treatment in emergency department patients with acute cardiogenic pulmonary oedema. Emerg. Med. J. 2004;21(2):155-161. DOI: 10.1136/emj.2003.005413. PubMed PMID: 14988338; PubMed Central PMCID: PMC1726258.
Briganti A, Melanie P, Portela D, et al. Continuous positive airway pressure administered via face mask in tranquilized dogs. J. Vet. Emerg. Crit. Care (San Antonio). 2010;20(5):503-508. Epub 20100929. DOI: 10.1111/j.1476-4431.2010.00579.x. PubMed PMID: 20955301.
Staffieri F, Crovace A, De Monte V, et al. Noninvasive continuous positive airway pressure delivered using a pediatric helmet in dogs recovering from general anesthesia. J. Vet. Emerg. Crit. Care (San Antonio). 2014;24(5):578-585. Epub 20140814. DOI: 10.1111/vec.12210. PubMed PMID: 25123478.
Pouzot-Nevoret C, Hocine L, Negre J, et al. Prospective pilot study for evaluation of high-flow oxygen therapy in dyspnoeic dogs: the HOT-DOG study. J. Small Anim. Pract. 2019;60(11):656-662. Epub 20190716. DOI: 10.1111/jsap.13058. PubMed PMID: 31313305.
Felker GM, O’Connor CM, Braunwald E. Heart Failure Clinical Research Network I. Loop diuretics in acute decompensated heart failure: necessary? Evil? A necessary evil? Circ. Heart Fail. 2009;2(1):56-62. DOI: 10.1161/CIRCHEARTFAILURE.108.821785. PubMed PMID: 19750134; PubMed Central PMCID: PMC2742422.
Martens P, Mullens W. How to tackle congestion in acute heart failure. Korean J. Intern. Med. 2018;33(3):462-473. Epub 20180411. DOI: 10.3904/kjim.2017.355. PubMed PMID: 29627971; PubMed Central PMCID: PMC5943665.
Boswood A, Murphy A. The effect of heart disease, heart failure and diuresis on selected laboratory and electrocardiographic parameters in dogs. J. Vet. Cardiol. 2006;8(1):1-9. Epub 20060427. DOI: 10.1016/j.jvc.2005.12.001. PubMed PMID: 19083331.
Adin DB, Taylor AW, Hill RC, et al. Intermittent bolus injection versus continuous infusion of furosemide in normal adult greyhound dogs. J. Vet. Intern. Med. 2003;17(5):632-636. DOI: 10.1111/j.1939-1676.2003.tb02493.x. PubMed PMID: 14529128.
Ohad DG, Segev Y, Kelmer E, et al. Constant rate infusion vs. intermittent bolus administration of IV furosemide in 100 pets with acute left-sided congestive heart failure: A retrospective study. Vet. J. 2018;238:70-75. Epub 20180729. DOI: 10.1016/j.tvjl.2018.07.001. PubMed PMID: 30103918.
Gelzer AR, Kraus MS, Rishniw M, et al. Combination therapy with digoxin and diltiazem controls ventricular rate in chronic atrial fibrillation in dogs better than digoxin or diltiazem monotherapy: a randomized crossover study in 18 dogs. J. Vet. Intern. Med. 2009;23(3):499-508. DOI: 10.1111/j.1939-1676.2009.0301.x. PubMed PMID: 19645836.
Goutal CM, Keir I, Kenney S, et al. Evaluation of acute congestive heart failure in dogs and cats: 145 cases (2007-2008). J. Vet. Emerg. Crit. Care (San Antonio). 2010;20(3):330-337. DOI: 10.1111/j.1476-4431.2010.00524.x. PubMed PMID: 20636986.
Luca Ferasin
Il Dr. Ferasin ha conseguito la laurea con lode nel 1992 all’Università di Bologna Scopri di più
State pensando di svolgere un internship negli USA? Questo articolo fornisce una breve guida ai vantaggi e svantaggi, come pure indicazioni su ciò che può essere offerto.
La prescrizione di fluidi EV ai gatti non è così semplice come potrebbe sembrare a prima vista; questo documento offre una panoramica completa delle conoscenze attuali.
La sepsi è un’emergenza medica nel cane; la sua rapida identificazione e un intervento proattivo sono essenziali per un esito positivo.
Cosa fare quando un paziente diabetico critico arriva nel pronto soccorso di una clinica? Questo lavoro offre un approccio graduale per ottimizzare i risultati.
