Internship veterinari negli USA
State pensando di svolgere un internship negli USA? Questo articolo fornisce una breve guida ai vantaggi e svantaggi, come pure indicazioni su ciò che può essere offerto.
Numero 32.3 altro: scientifici
Pubblicato il 12/04/2023
Disponibile anche in Français , Deutsch , Español e English
La sepsi è un’emergenza medica nel cane; la sua rapida identificazione e un intervento proattivo sono essenziali per un esito positivo.

La presenza della sepsi va considerata un’emergenza medica ed è essenziale una diagnosi rapida per ottenere un esito positivo.
Il passaggio dalla sepsi all’insufficienza multiorgano e allo shock settico può essere prevenuto con una rianimazione rapida e adeguata.
La terapia antibiotica è essenziale nei pazienti critici con sepsi sospetta e segni di shock.
Valutare, rivalutare e ancora rivalutare: la sepsi è una situazione che progredisce costantemente, e richiede un monitoraggio intensivo della risposta al trattamento.
La sepsi è un’emergenza medica riconosciuta fin dai tempi di Ippocrate, intorno al 400 a.C., quando veniva associata a qualsiasi condizione che causasse la putrefazione della carne, e il medico persiano Avicenna ha proseguito, circa 1400 anni dopo, descrivendo la sepsi come una putrefazione del sangue e dei tessuti accompagnata da febbre 1. Oggi sappiamo che questa condizione è una malattia sistemica causata da una risposta incontrollata del sistema immunitario a una condizione infettiva. Ciò può causare disfunzione di uno o più organi, che è la causa più comune di mortalità nei pazienti con sepsi, motivo per cui sono estremamente importanti una diagnosi precoce e un piano di trattamento efficace.
Le prime definizioni di sepsi nella medicina moderna sono state stabilite nel 1991 (nota come Sepsi versione 1), e sebbene siano cambiate nel corso degli anni (Sepsi versioni 2 e 3), i concetti primari sono ancora quelli usati più spesso per scopi pratici in Medicina veterinaria 2. L’idea iniziale alla base della definizione era standardizzare i criteri e stabilire linee guida per facilitare il riconoscimento e il trattamento dei pazienti con sepsi nel modo più rapido ed efficace possibile. Questi concetti includono:
Tabella 1. Criteri per identificare un cane con SIRS.
| Temperatura (° C/F) | ≤ 37,2/99,0 oppure ≥ 39,2/102,5 |
| Frequenza cardiaca (battiti/minuto) | ≥ 140 |
| Frequenza respiratoria (atti respiratori/minuto) | > 20 |
| Leucociti (x 103/µL) | ≥ 16 oppure ≤ 6 |
| Bande (%) | ≥ 3 |
È fondamentale comprendere il concetto di SIRS. La SIRS è la risposta sistemica a qualsiasi disturbo che causa infiammazione, che può essere inizialmente diffusa, come ad esempio nel paziente che ha avuto un colpo di sole, oppure localizzata, come nel caso della pancreatite acuta. Il corpo non riesce mantenere la risposta infiammatoria nel focolaio originale, e così la condizione infiammatoria diventa generalizzata e inizia a influenzare i tessuti sani situati in altre aree corporee non correlate alla causa originale. Pertanto, a prescindere dalla causa iniziale, tutti i sistemi corporei possono mostrare segni di infiammazione. Se la condizione iniziale è di origine infettiva, il paziente è settico per definizione; in altre parole, tutti i pazienti con sepsi hanno un’infiammazione sistemica (cioè, SIRS), ma non tutti i pazienti con SIRS hanno una sepsi (ad es. lesioni, colpo di sole, pancreatite).
Tabella 2. Definizioni della disfunzione d’organo nel cane.
| Sistema organico | Criterio |
|---|---|
| Renale |
Produzione di urina <0,5 mL/kg/ora per ≥ 12 ore, o aumento della creatinina sierica ≥ 0,3 mg/dL senza evidenza di azotemia pre- o post-renale
|
| Cardiovascolare |
Ipotensione che richiede l’uso di agenti vasopressori
|
| Respiratorio |
Necessità di somministrazione di ossigeno o ventilazione assistita, in base alla valutazione clinica, all’emogasanalisi arteriosa (gradiente alveolo-arterioso >10 mmHg) e/o alla pulsossimetria (SpO2 <95%).
|
| Fegato |
Bilirubina totale sierica o plasmatica >0,5 mg/dL
|
| Coagulazione |
Tempo di protrombina o tempo di tromboplastina parziale attivata >25% rispetto al limite di riferimento superiore e/o conta piastrinica ≤ 100.000/µL
|
Secondo il concetto illustrato sopra, il primo passo è stabilire se il paziente sta avendo una risposta infiammatoria sistemica. I criteri utilizzati includono variazioni in termini di frequenza respiratoria (tachipnea), frequenza cardiaca (bradicardia o tachicardia) e temperatura rettale (ipotermia o febbre), nonché anomalie dei parametri ematici (leucopenia o leucocitosi con o senza spostamento a sinistra) (Tabella 1). La presenza di due o più di questi criteri in un cane è sufficiente per confermare la SIRS 3. Il valore diagnostico di essi sta nella loro semplicità; non sono necessari test più sofisticati, ed è possibile identificare rapidamente il paziente affetto. Il problema principale è che i criteri non sono specifici, e la maggior parte dei pazienti ricoverati in un ospedale veterinario soddisfa uno o più criteri per la SIRS. Tuttavia, come regola generale, più criteri mostra un paziente, maggiore è la probabilità di SIRS. Un cane con tachicardia, tachipnea, febbre e leucocitosi ha molte più probabilità di essere affetto da SIRS rispetto a uno con solo tachicardia e tachipnea, poiché questi cambiamenti potrebbero essere dovuti allo stress e all’ansia associati alla permanenza nella clinica.
Il passo successivo è stabilire se l’origine della condizione infiammatoria sistemica è infettiva (cioè, sepsi) o meno. A questo servono l’anamnesi clinica e l’esame obiettivo (Figura 1). In alcuni casi, come ad esempio il rilevamento di un ascesso cutaneo da morso, è facile stabilire la causa iniziale; in altri casi, può essere più difficile, e richiedere un’indagine più completa. In tutti i casi di sepsi sospetta, come minimo sono sempre consigliabili un test ematologico completo (ematologia e biochimica) e una valutazione urinaria (compresa la coltura). I risultati dei test ematologici possono mostrare, ad esempio, la presenza di leucocitosi o leucopenia, trombocitopenia, ipoalbuminemia, iperbilirubinemia, ipocalcemia, azotemia e iperglicemia o ipoglicemia, che sono i disturbi più comuni nei pazienti con sepsi. Questi test iniziali possono essere integrati con altri strumenti diagnostici alla ricerca del focolaio dell’infezione, incluse radiografie del torace, dell’addome e/o della colonna vertebrale (Figura 2); l’ecografia addominale e/o toracica e altre modalità di diagnostica per immagini, se disponibili (Figura 3); l’esame del fluido cerebrospinale e/o sinoviale; la sierologia e/o la PCR per le malattie infettive in base alla presentazione clinica e alla localizzazione geografica. Come regola generale, qualsiasi accumulo anomalo di fluido deve essere indagato mediante citologia, poiché la presenza di batteri intracellulari conferma l’infezione; inoltre, va conservato un campione per eseguire più avanti la coltura e antibiogramma, se necessario (Figura 4). Se un paziente ha una peritonite settica sospetta ma assenza di batteri intracellulari nel fluido peritoneale, i livelli glicemici possono essere confrontati con la concentrazione di glucosio nel fluido peritoneale; una differenza superiore a 20 mg/dl (sangue > fluido peritoneale) è compatibile con la diagnosi di peritonite settica 4. Tuttavia, sebbene si possa sospettare una causa infettiva alla valutazione iniziale, non è sempre possibile confermarla, e quindi il medico veterinario deve considerare altre possibilità, o monitorare la risposta al trattamento attraverso la rivalutazione frequente del paziente.

Figura 1. Mucose orali congestionate in un cane con SIRS.
© Rocio Redondo

Figura 2. Radiografia toracica laterale di un cane con polmonite ab ingestis. Si nota la presenza di broncogrammi alveolari nei lobi polmonari craniali destro e sinistro e nel lobo medio destro; è anche presente una dilatazione esofagea generalizzata.
© Rafael Obrador de Aguilar
La presentazione clinica di un cane con sepsi può essere molto variabile, e sebbene alcuni animali richiedano un trattamento intensivo per sopravvivere, altri possono essere trattati in regime ambulatoriale. Punti importanti per la stabilizzazione di questi pazienti sono la rianimazione, il controllo della fonte d’infezione, la somministrazione di antibiotici, e l’uso di agenti vasopressori (se è presente shock settico).
 |
| a |
 |
| b |
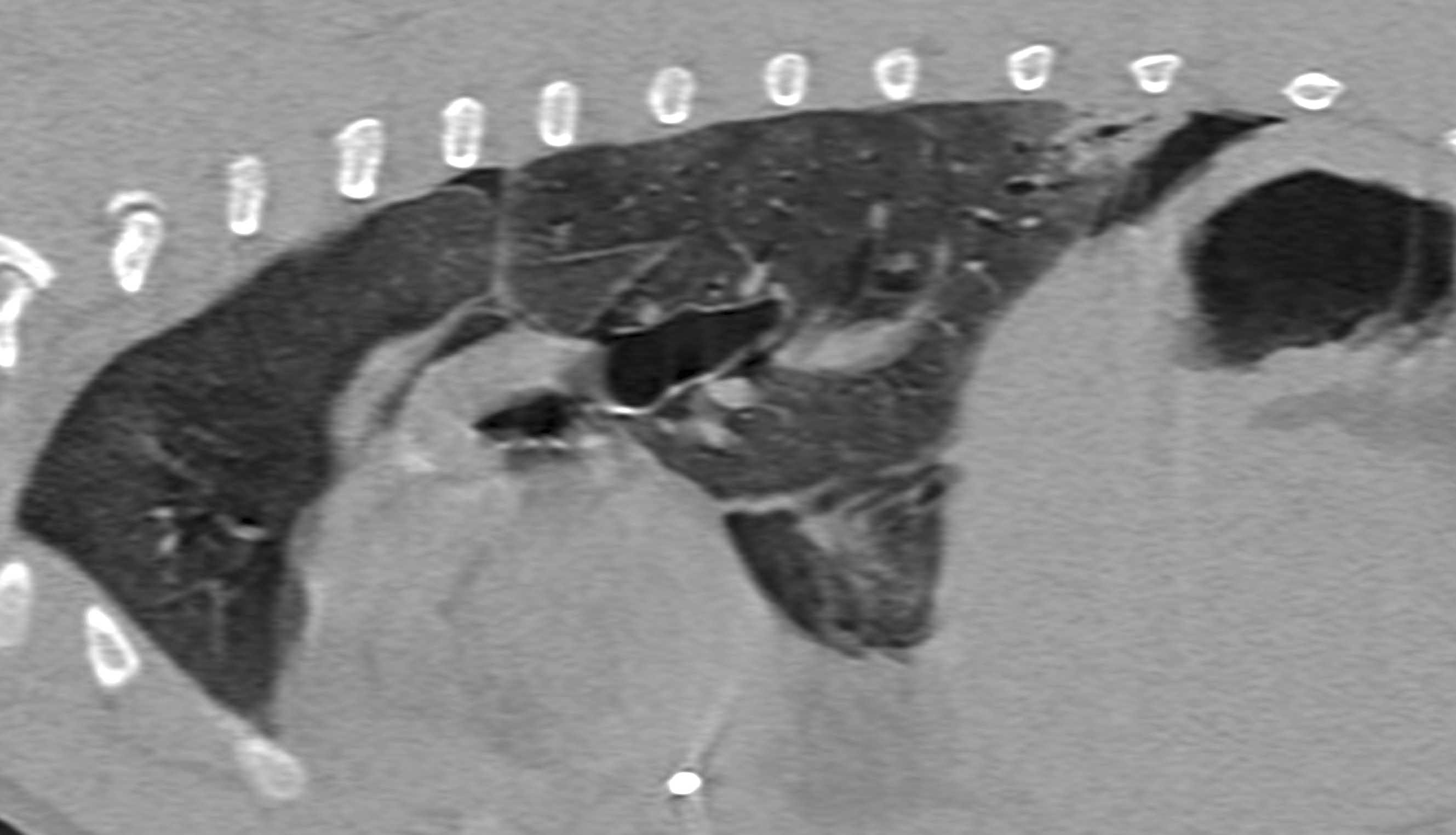
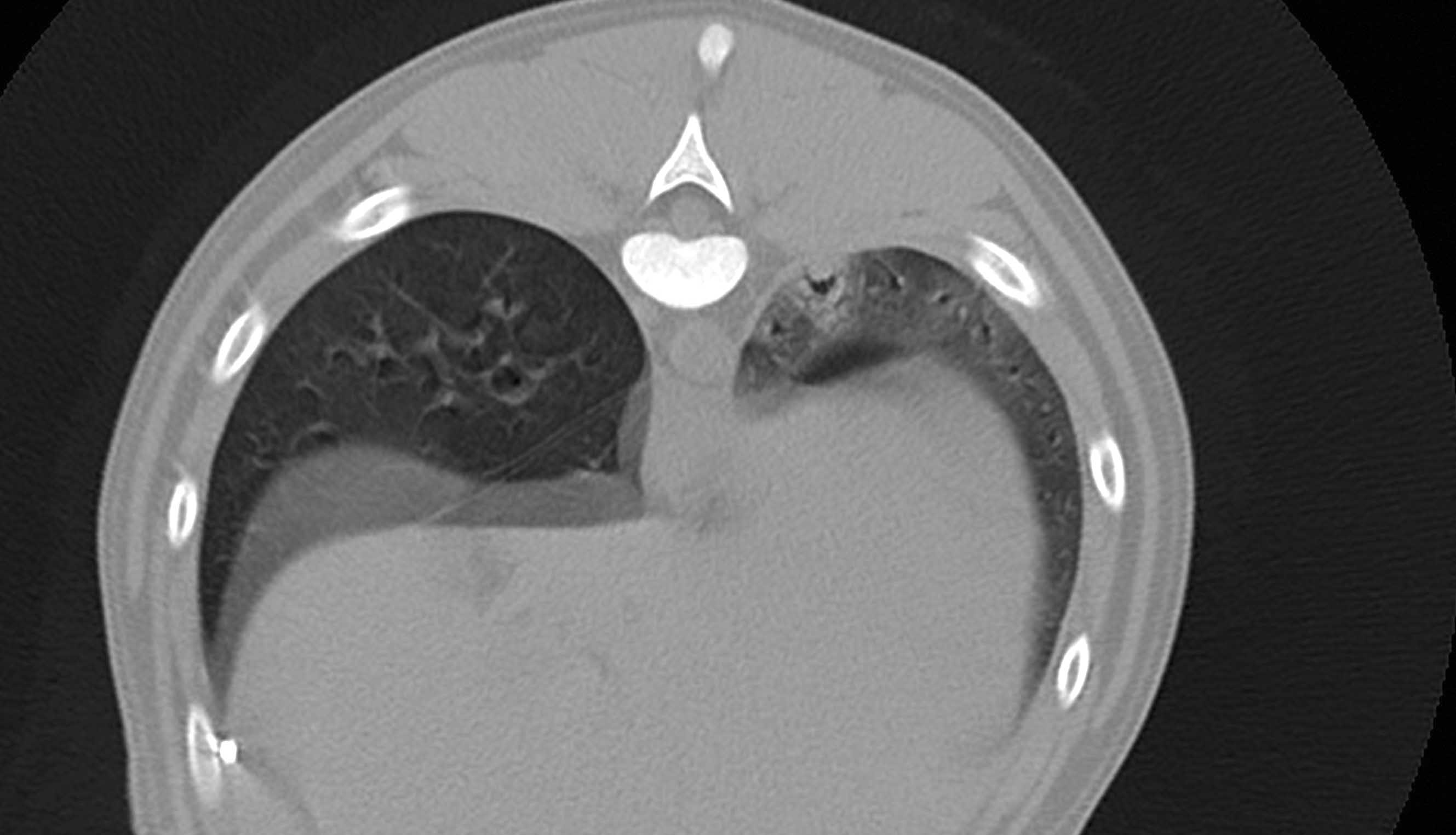
Figura 3. Immagini in vista sagittale (a) e trasversale (b) ottenute mediante tomografia computerizzata in un paziente con sepsi e piotorace secondario alla migrazione di un’arista vegetale. Il lobo polmonare caudale sinistro è stato allontanato dalla parete toracica e mostra un pattern alveolare focale; è anche visibile un piccolo broncogramma aereo.
© Rafael Obrador de Aguilar
La rianimazione in un cane con sepsi è diversa da quella dei pazienti con altre forme di shock. Nella sepsi, la causa dell’insufficienza emodinamica è la combinazione di ipovolemia assoluta (che trae vantaggio dalla somministrazione di fluidi) e ipovolemia relativa secondaria all’aumento della permeabilità vascolare che causa perdita di fluidi, perdita del tono vascolare e (in alcuni pazienti) disfunzione miocardica. Il grado in cui ognuno di questi fattori può influenzare un dato individuo è molto variabile e dinamico. È logico presumere che un approccio terapeutico standardizzato non porti gli stessi benefici a tutti i pazienti; quindi, è di gran lunga preferibile personalizzare il protocollo di fluidoterapia per ogni animale in base ai relativi fabbisogni.
 |
 |
| a | b |
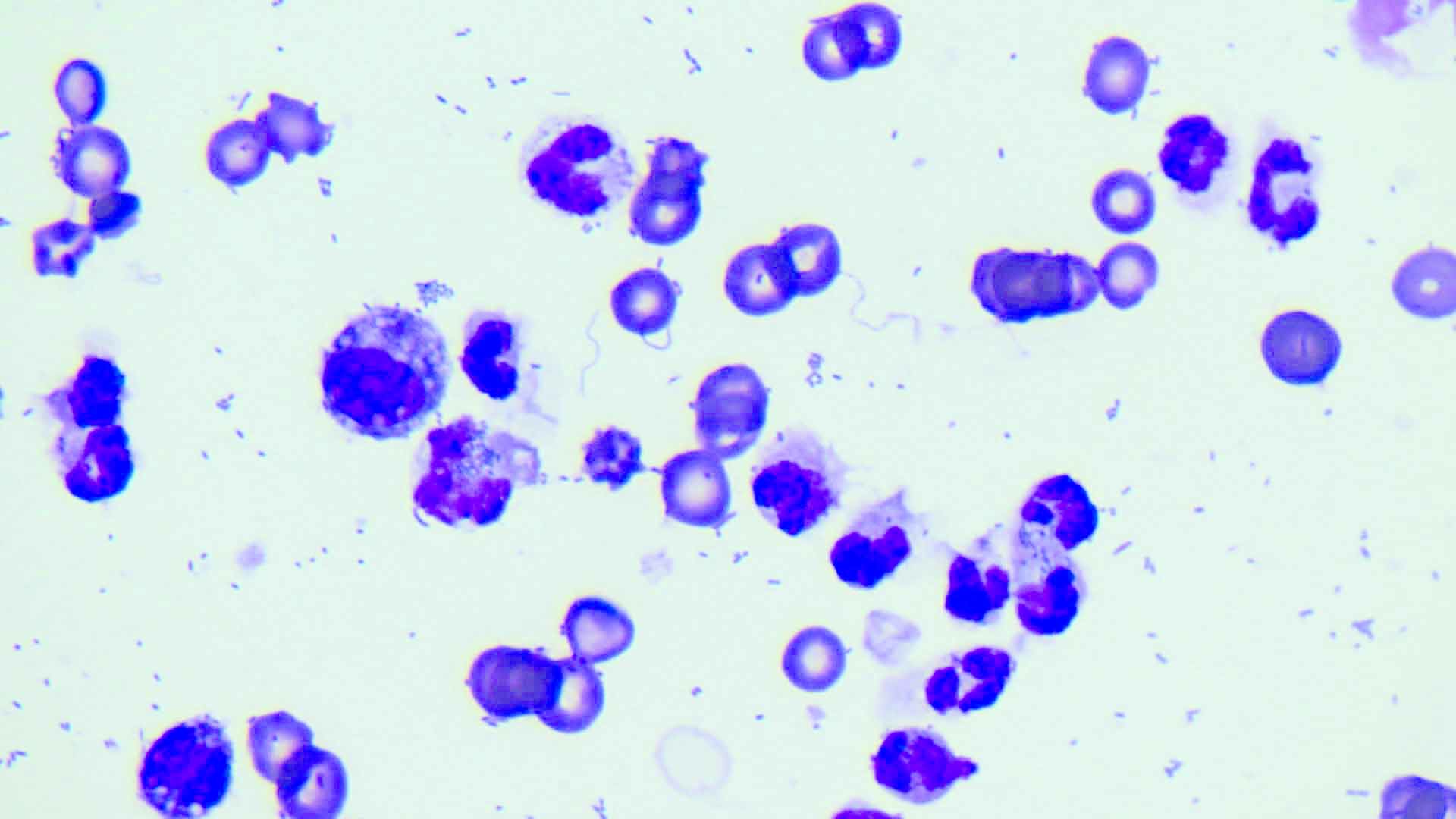
Figura 4. (a) Campione ottenuto mediante addominocentesi in un paziente con addome settico. (b) La citologia del fluido mostra la presenza di batteri intracellulari (ingrandimento x100).
© Rafael Obrador de Aguilar
Attualmente, sebbene nessuna strategia per la somministrazione di fluidi (tipo, volume e frequenza) si sia dimostrata superiore nel trattamento dei pazienti con sepsi, è molto importante considerare il tempo necessario alla rianimazione una volta identificati i disturbi emodinamici; idealmente questo dovrebbe avvenire sempre entro 20-30 minuti. Infatti, la somministrazione precoce di fluidi può modulare la condizione infiammatoria e persino ridurre la necessità di agenti vasopressori (Figura 5), mentre una somministrazione ritardata o insufficiente è associata al peggioramento della condizione emodinamica, del flusso ematico del microcircolo, e della disfunzione d’organo 5,6,7. Si raccomanda pertanto di avviare la rianimazione con un cristalloide isotonico bilanciato (ad es. Ringer lattato) 8. In genere si somministra un bolo endovenoso (10-20 mL/kg in circa 15 minuti) mentre vengono monitorati i parametri di perfusione (cioè, stato mentale, frequenza cardiaca, colore delle mucose, tempo di riempimento capillare, temperatura delle estremità, qualità del polso) per migliorare o persino normalizzare questi parametri. Se la risposta del paziente non è favorevole (cioè, i parametri di perfusione non stanno migliorando), il bolo di fluidi può essere ripetuto due o tre volte, verificando che non vi siano segni tali da indicare un possibile sovraccarico di volume (cioè, tremore, nausea, respiro sibilante, chemosi, scolo nasale sieroso, aumento della frequenza respiratoria e/o dello sforzo respiratorio, edema sottocutaneo, crepitii all’auscultazione polmonare); in questo caso, l’ulteriore somministrazione di fluidi è dannosa e non indicata.
Una volta rianimato il paziente, il programma di somministrazione dei fluidi deve essere adattato, come per qualsiasi soggetto ricoverato, in base allo stato di disidratazione dell’animale, ai fabbisogni fisiologici quotidiani, e alle possibili perdite di fluidi in corso. Tuttavia, circa il 15% dei pazienti con sepsi progredisce verso lo shock settico, caratterizzato da insufficienza circolatoria, disfunzione d’organo multipla, e aumento della mortalità. A questo punto neppure una somministrazione di fluidi adeguata può invertire la conseguente ipotensione sistemica, ed è necessaria l’aggiunta di agenti vasopressori (vedere di seguito).

Figura 5. La somministrazione di fluidi in un cane con shock settico deve essere avviata prima possibile, utilizzando un cristalloide isotonico bilanciato.
© Shutterstock
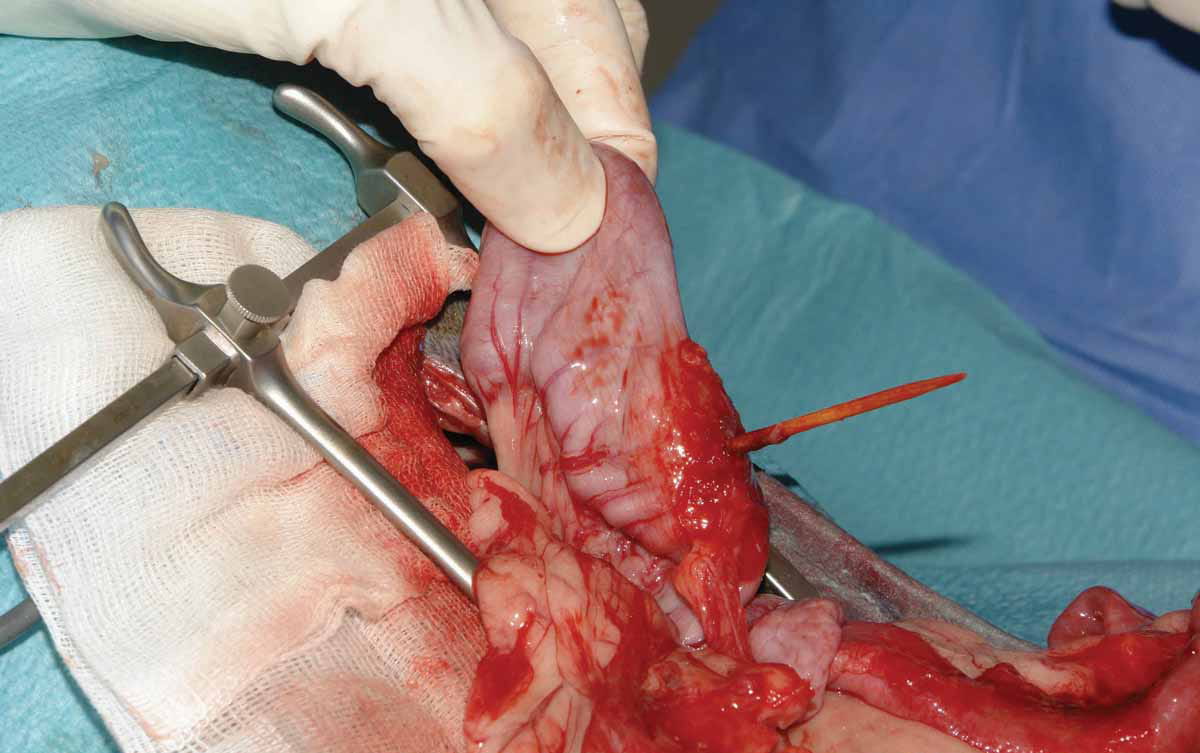
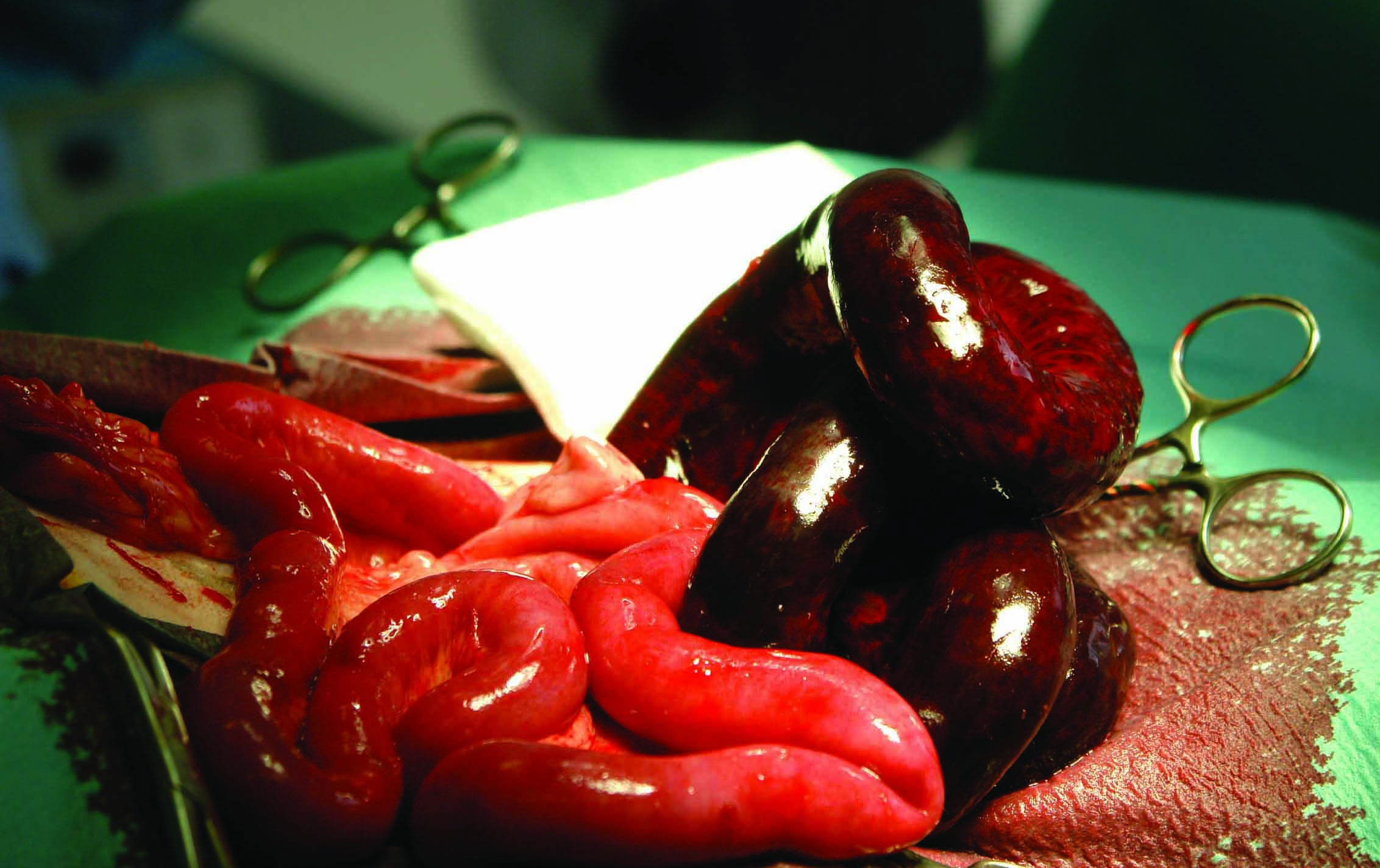
Il controllo del focolaio dell’infezione consente la rimozione della causa originale e previene la possibile progressione verso la disfunzione d’organo nei pazienti con sepsi. Pertanto, una volta ottenuta la rianimazione, è fondamentale drenare o rimuovere chirurgicamente il tessuto infetto prima possibile, poiché è noto che una rimozione adeguata e precoce del focolaio infettivo ha un impatto positivo sulla prognosi del paziente (Figura 6) 9. Questo passaggio consente anche di ottenere campioni microbiologici da analizzare.
 |
| a |
 |
| b |
 |
| c |
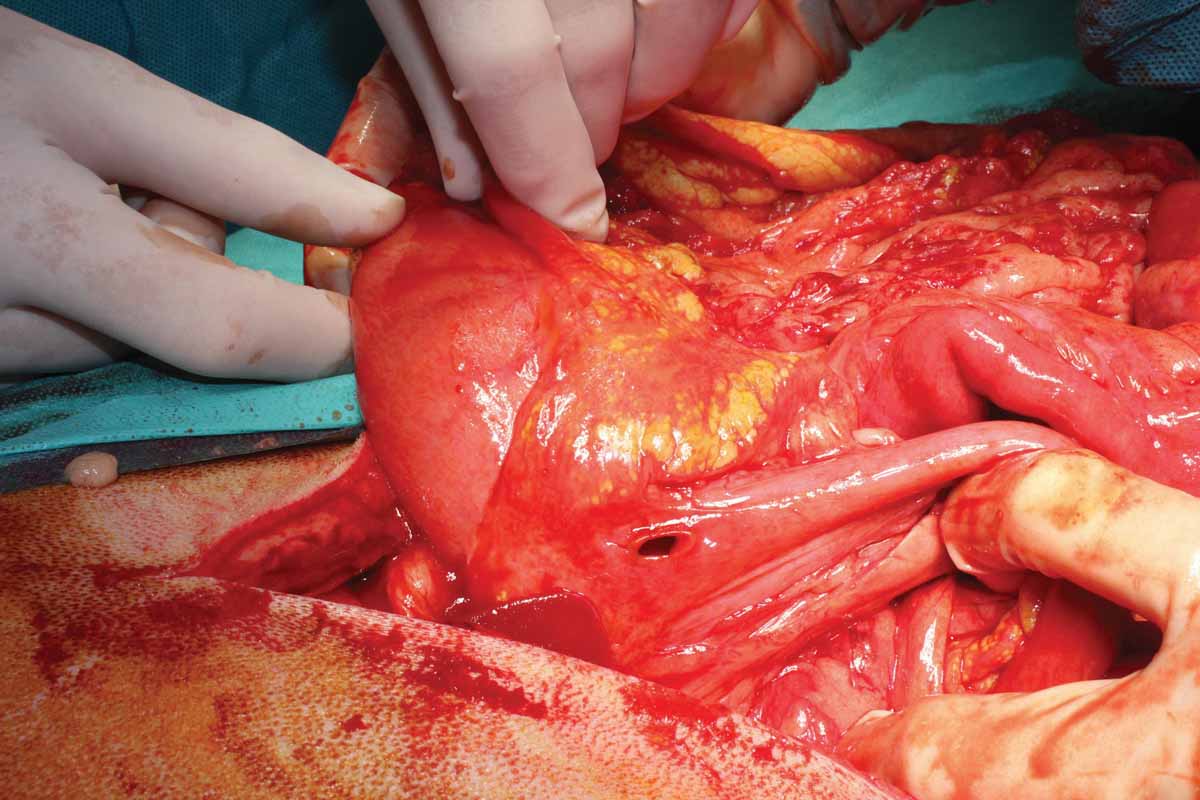
Figura 6. Esempi di addome settico: (a) perforazione duodenale secondaria all’uso di farmaci antinfiammatori non steroidei; (b) perforazione intestinale da corpo estraneo; e (c) torsione mesenterica.
© Nuria Vizcaíno
Una terapia antibiotica appropriata e precoce è uno dei pilastri principali nel trattamento della sepsi, e in particolare nei pazienti più critici, come ad esempio quelli con disfunzione d’organo o shock settico. Quando possibile, e purché non ritardi la somministrazione dell’antibiotico, si consiglia di ottenere campioni per la coltura e l’antibiogramma. Finché non si ottengono i risultati del campione, è necessaria una terapia empirica, selezionando un antimicrobico ad ampio spettro verosimilmente efficace contro i microrganismi potenzialmente responsabili del problema. Altri fattori da considerare includono le condizioni del paziente (valutando, cioè, se l’antibiotico di preferenza richiede la somministrazione orale o endovenosa), e la possibilità di infezioni multifarmaco-resistenti (a causa di precedenti esposizioni ad antibiotici, ricoveri recenti, o infezione comunitaria acquisita). La dose scelta deve essere appropriata per massimizzare l’eradicazione del patogeno, minimizzando al contempo il rischio di sviluppo della resistenza agli antimicrobici, ed evitando le reazioni avverse. Alcuni esempi di terapia combinata per i pazienti con sepsi che devono essere ricoverati, e che non hanno ricevuto antibiotici nelle settimane precedenti il ricovero includono 10:
La combinazione empirica prescelta va successivamente adattata in base ai progressi del paziente e ai risultati della coltura/dell’antibiogramma, secondo la cosiddetta procedura di de-intensificazione. Ciò comporta l’adeguamento dello spettro e del numero di antibiotici al minimo indispensabile per ottenere un controllo adeguato dell’infezione una volta identificato il microrganismo. Ciò dimostra un uso razionale degli antibiotici, minimizzando il rischio di effetti indesiderati e contribuendo a prevenire la resistenza batterica.
Se si rileva un’ipotensione sistemica (pressione arteriosa sistolica <90 mmHg) in un paziente con sepsi senza risposta alla rianimazione con fluidi (shock settico), occorre avviare prima possibile il trattamento con agenti vasopressori 11. L’introduzione precoce degli agenti vasopressori nei pazienti con shock settico è associata a volumi ridotti di fluidi per rianimazione, entità minori di fluido intra-tissutale accumulato, e durata ridotta dell’ipotensione, fattori che potrebbero ridurre la mortalità del paziente12. L’obiettivo è cercare di aumentare la resistenza vascolare sistemica migliorando la pressione arteriosa, così da mantenere la perfusione degli organi vitali. Se il paziente aveva in precedenza una pressione arteriosa normale, la pressione sistolica va mantenuta sopra 90-100 mmHg.
I due farmaci vasopressori più spesso usati in medicina veterinaria sono la noradrenalina (norepinefrina) e la dopamina (Tabella 3). La noradrenalina è una catecolamina che aumenta la pressione arteriosa grazie principalmente alle sue proprietà di vasocostrizione, con un effetto minimo sulla frequenza cardiaca (effetto α-1 marcato e β-1 moderato). Inoltre, con un’adeguata rianimazione del volume, il flusso ematico renale migliora e i livelli di lattato diminuiscono. La dopamina è il precursore naturale della noradrenalina nell’organismo, sebbene i suoi effetti siano leggermente diversi e dose-dipendenti. In generale, rispetto alla noradrenalina, i suoi effetti a dosi intermedie (3-10 µg/kg/min) sono più marcati sul cuore (β-1) e più deboli a livello vascolare (α-1); quindi, esiste un rischio maggiore di tachicardia e/o aritmie, motivo per cui il farmaco viene usato meno spesso della noradrenalina. Tuttavia, alla fine, la scelta dipende dalle preferenze personali e dalla familiarità del veterinario.
Tabella 3. Agenti vasopressori nel cane: meccanismo d’azione e dosi raccomandate.
| Agente vasopressore | α | β1 | β2 |
Capacità contrattile | Frequenza cardiaca |
Tono vascolare |
Pressione arteriosa |
Dose |
|---|---|---|---|---|---|---|---|---|
| Dobutamina | + | + | ++ | ↑↑ | ↑ | ↓ | Variabile | 5-20 µg/kg/minuto |
| Dopamina | ++ | + | ++ | ↑↑ | ↑↑ | ↑↑ | ↑↑ | 5-20 µg/kg/minuto |
| Adrenalina | +++ | +++ | +++ | ↑↑↑ | ↑↑↑ | ↑↑↑ | ↑↑↑ | 0,05-1,0 µg/kg/minuto |
| Noradrenalina | +++ | + | 0 | ↑ | Variabile | ↑↑↑ | ↑↑↑ | 0,1-2,0 µg/kg/minuto |
| Vasopressina | 0 | 0 | 0 | 0 | ↓ | ↑↑ | ↑↑ |
0,5-5,0 mU/kg/minuto
|
Entrambi i farmaci vengono somministrati mediante infusione endovenosa a velocità costante (CRI), inizialmente al limite inferiore della dose raccomandata, per poi aumentare gradualmente fino al punto in cui il paziente può essere stabilizzato emodinamicamente (pressione sistolica >90-100 mmHg). Tuttavia, in alcuni cani con shock settico, l’ipotensione potrebbe non migliorare nonostante la somministrazione di fluidi e dosi elevati di agenti vasopressori, una situazione nota come shock refrattario 13. In questi casi, il paziente deve essere rivalutato e vanno indagate le possibili cause dello shock refrattario (Tabella 4).
Tabella 4. Cause dello shock refrattario.
|
La somministrazione di glucocorticoidi non è raccomandata nei pazienti con sepsi se è possibile mantenere la stabilità emodinamica con la fluidoterapia e/o gli agenti vasopressori. Tuttavia, se un cane con shock settico non ha risposto all’espansione del volume, e l’ipotensione persiste nonostante dosi elevate di catecolamine, è indispensabile valutare la somministrazione di corticosteroidi 14,15. Questa classe farmacologica aumenta la risposta α-adrenergica vascolare e riduce la vasodilatazione associata all’infiammazione. Le opzioni raccomandate includono la somministrazione di un bolo endovenoso di idrocortisone (1 mg/kg seguito da CRI da 0,08 mg/kg/ora 16) o desametasone (utilizzando una CRI da 0,01-0,02 mg/kg/ora).
Nella specie canina, il tratto digerente viene considerato come “organo dello shock”, ed è quindi soggetto a problemi di ipoperfusione, poiché il flusso ematico viene deviato verso gli organi più importanti, quando necessario. Questo effetto, in combinazione con la presenza di anoressia, può influenzare in modo significativo la permeabilità della barriera gastrointestinale, con rischio di traslocazione batterica (o di endotossine). Inoltre, i pazienti con sepsi che sono anoressici sono particolarmente suscettibili alla malnutrizione, da qui l’importanza di avviare la nutrizione prima possibile; tuttavia, il paziente va prima idratato e dev’essere emodinamicamente stabile, senza disturbi elettrolitici significativi. Se il paziente è anoressico, la nutrizione può essere volontaria o fornita mediante sondini di alimentazione. Il primo obiettivo è fornire nutrienti agli enterociti per mantenere la funzione di barriera gastrointestinale, e il livelli potrebbero quindi essere inizialmente inferiori ai fabbisogni energetici a riposo (RER) del cane (calcolati con la formula 70 x (peso in kg)0,75).
Le variazioni nella regolazione della glicemia sono frequenti nei pazienti con sepsi, e sono caratterizzate da iperglicemia nelle fasi iniziali, seguita dall’ipoglicemia all’aumentare della gravità della malattia. Si raccomanda di mantenere i livelli di glucosio tra 70 e 140 mg/dL. Per i pazienti ipoglicemici va somministrato un bolo di glucosio per via endovenosa (0,5-1,0 mL/kg di glucosio diluito al 50%). Se la risposta al bolo è temporanea, è possibile integrare i fluidi di mantenimento con glucosio (2,5-5%). Se i livelli glicemici superano continuamente i 150 mg/dL, è possibile avviare la somministrazione di insulina regolare tramite CRI (0,05-0,1 UI/kg/ora), accompagnata dal monitoraggio intensivo dei livelli glicemici.
Rafael Obrador de Aguilar
La prognosi dei pazienti con sepsi dipende dalla gravità della condizione, dalla causa sottostante iniziale, e dalla presenza o assenza di disfunzione d’organo. Nei cani con sepsi non complicata, la prognosi è buona con tassi di sopravvivenza intorno all’84%. Tuttavia, non appena l’animale inizia a manifestare disfunzione d’organo o shock settico, la prognosi peggiora molto. Infatti, la mortalità è chiaramente associata alla disfunzione d’organo, e aumenta con il numero di sistemi organici colpiti 17. Tuttavia, il danno tissutale non è necessariamente irreversibile, e può attenuarsi in parte o completamente se si tratta con successo la causa sottostante dell’infiammazione.
La sepsi è un’emergenza medica in cui la prognosi dipende dalla velocità con cui vengono intraprese alcune procedure, sia per la diagnosi, sia per la gestione terapeutica del paziente. La valutazione e la rivalutazione devono essere eseguite tutte le volte che serve, poiché si tratta di una condizione in costante progresso che richiede un monitoraggio intensivo della risposta al trattamento.
Funk DJ, Parrillo JE, Kumar A. Sepsis and septic shock: a history. Crit. Care Clin. 2009;125(1):83-101.
Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis: the ACCP/SCCM consensus conference committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992;101(6): 1644-1655.
Greiner M, Wolf G, Hartmann K. A retrospective study of the clinical presentation of 140 dogs and 39 cats with bacteraemia. J. Small Anim. Pract. 2008;49(8):378-383.
Bonczynski JJ, Ludwig LL, Barton LJ, et al. Comparison of peritoneal fluid and peripheral blood pH, bicarbonate, glucose, and lactate concentration as a diagnostic tool for septic peritonitis in dogs and cats. Vet. Surg. 2003;32(2):161-166.
Leisman DE, Doerfler ME, Schneider SM, et al. Predictors, prevalence, and outcomes of early crystalloid responsiveness among initially hypotensive patients with sepsis and septic shock. Crit. Care Med. 2018;46(2):189-198.
Morley PT. Early fluid management in sepsis: yes. Crit. Care Med. 2018;46(2):327-328.
Ospina-Tascon G, Neves AP, Occhipinti G, et al. Effects of fluids on microvascular perfusion in patients with severe sepsis. Intens. Care Med. 2010;36(6):949-955.
Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intens. Care Med. 2017;43:304-377.
Rausei S, Pappalardo V, Ruspi L, et al. Early versus delayed source control in open abdomen management for severe intra-abdominal infections: a retrospective analysis on 111 cases. World J. Surg. 2018;42(3):707-712.
Hardie, E. Therapeutic management of sepsis. In; Bonagura J (ed): Kirk´s Current Veterinary Therapy: XIII Small Animal Practice Philadelphia: WB Saunders, 2000;272-275.
Cecconi M, De Backer D, Antonelli M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task Force of the European Society of Intensive Care Medicine. Intens. Care Med. 2014;40(12):1795-1815.
Ospina-Tascón G, Hernandez G, Alvarez I, et al. Effects of very early start of norepinephrine in patients with septic shock: a propensity score-based analysis. Crit. Care 2020;24(1):52.
Kimmoun A, Ducrocq N, Levy B. Mechanisms of vascular hyporesponsiveness in septic shock. Curr. Vasc. Pharmacol. 2013;11:139-149.
Annane D, Pastores SM, Rochwerg B, et al. Guidelines for the diagnosis and management of critical illness-related corticosteroid insufficiency (CIRCI) in critically ill patients (part I): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Intens. Care Med. 2017;43:1751-1763.
Pastores SM, Annane D, Rochwerg B. Corticosteroid Guideline Task Force of SCCM and ESICM. Guidelines for the diagnosis and management of critical illness-related corticosteroid insufficiency (CIRCI) in critically ill patients (part II): Society of Critical Care Medicine (SCCM) and European Society of Intensive Care Medicine (ESICM) 2017. Crit. Care Med. 2018;46:146-148.
Summers AM, Culler C, Yaxley PE, et al. Retrospective evaluation of the use of hydrocortisone for treatment of suspected critical illness-related corticosteroid insufficiency (CIRCI) in dogs with septic shock (2010-2017): 47 cases. J. Vet. Emerg. Crit. Care 2021;31:371-379.
Kenney EM, Rozanski EA, Rush JE, et al. Association between outcome and organ system dysfunction in dogs with sepsis: 114 cases (2003-2007). J. Am. Vet. Med. Assoc. 2010;236(1):83-87.
Rafael Obrador de Aguilar
Il Dr. Obrador ha conseguito la laurea in Scienze veterinarie presso l’Università di Zaragoza Scopri di più
State pensando di svolgere un internship negli USA? Questo articolo fornisce una breve guida ai vantaggi e svantaggi, come pure indicazioni su ciò che può essere offerto.
La prescrizione di fluidi EV ai gatti non è così semplice come potrebbe sembrare a prima vista; questo documento offre una panoramica completa delle conoscenze attuali.
L’insufficienza cardiaca acuta nei cani è associata a un grave rischio di morte, ed è quindi fondamentale ottimizzare la diagnosi e il trattamento, come discusso da Luca Ferasin.
Cosa fare quando un paziente diabetico critico arriva nel pronto soccorso di una clinica? Questo lavoro offre un approccio graduale per ottimizzare i risultati.
